Sotyktu es un inhibidor de tirosina quinasa 2 (TYK2) oral. Es el único inhibidor de TYK2 aprobado en todo el mundo y el primer tratamiento oral aprobado para la psoriasis en placas en casi 10 años.

Bristol Myers Squibb , anunció hoy que la Administración de Alimentos y Medicamentos (FDA) de EE. UU. aprobó Sotyktu (deucravacitinib), el primer medicamento alostérico oral, selectivo Inhibidor de la tirosina quinasa 2 (TYK2), para el tratamiento de adultos con psoriasis en placas de moderada a grave que son candidatos para terapia sistémica o fototerapia. No se recomienda el uso de Sotyktu en combinación con otros inmunosupresores potentes
La aprobación se basa en los resultados de los ensayos clínicos pivotales de fase 3 POETYK PSO-1 y POETYK PSO-2, que demostraron una eficacia superior de Sotyktu una vez al día en comparación con el placebo y Otezla (apremilast) dos veces al día en 1684 pacientes de 18 años y mayores con psoriasis en placas de moderada a grave. 1 La eficacia superior de Sotyktu en comparación con el placebo y Otezla se demostró a las 16 y 24 semanas, y las respuestas con Sotyktu persistieron durante 52 semanas. Vea abajo para más información.
Así luce la píldora Sotyktu. Foto: Bristol Myers Squibb
“Sotyktu tiene el potencial de convertirse en el nuevo estándar de tratamiento oral para personas con psoriasis en placas de moderada a grave, dado su perfil para ayudar a los pacientes a lograr una piel más clara, como se demostró en el programa clínico POETYK PSO”, dijo April Armstrong, MD, MPH, investigador clínico en el ensayo POETYK PSO-1, decano asociado y profesor de dermatología en la Universidad del Sur de California. “Las personas que viven con psoriasis en placas de moderada a grave enfrentan cargas significativas, y Sotyktu es una opción de tratamiento sistémico de primera línea bienvenida”.
Un nuevo futuro para los pacientes con psoriasis
“La aprobación de Sotyktu representa un día emocionante para los pacientes que padecen psoriasis en placas de moderada a grave que no están satisfechos con los tratamientos tópicos y convencionales. Este es otro logro extraordinario para Bristol Myers Squibb, ya que presentamos un nuevo mecanismo de acción, el primer tratamiento oral aprobado en casi 10 años y el primer tratamiento de una vez al día con dosis oral para la psoriasis en placas de moderada a grave”, dijo Samit Hirawat, MD, director médico, Bristol Myers Squibb. “Creemos que Sotyktu es un gran avance en el tratamiento de pacientes con esta afección y estamos entusiasmados con su potencial en otras enfermedades inmunomediadas”.
En los ensayos de POETYK PSO, en la semana 16, las reacciones adversas más comunes (=1 por ciento y más que el placebo) en pacientes con Sotyktu fueron infecciones de las vías respiratorias superiores (19,2 por ciento), aumento de la creatina fosfoquinasa en sangre (2,7 por ciento), herpes simple (2,0 por ciento), úlceras bucales (1,9 por ciento), foliculitis (1,7 por ciento) y acné (1,4 por ciento). Además, el 2,4 % de los pacientes con Sotyktu , el 3,8 % de los pacientes con placebo y el 5,2 % de los pacientes con Otezla experimentaron reacciones adversas que llevaron a la suspensión.
“A pesar de la disponibilidad de terapias, muchas personas que viven con psoriasis en placas en los Estados Unidos no reciben tratamiento o reciben tratamiento insuficiente, dijo Leah M. Howard, JD, presidenta y directora ejecutiva de la Fundación Nacional de Psoriasis. “La aprobación de la FDA de un nuevo tratamiento oral es una noticia emocionante para la comunidad de la psoriasis. Damos la bienvenida a esta nueva opción de tratamiento”.
Bristol Myers Squibb agradece a los pacientes e investigadores involucrados en el programa de ensayos clínicos POETYK PSO. Se espera que Sotyktu esté disponible para pacientes en los EE. UU. en septiembre de 2022.
Acerca de POETYK PSO-1 y POETYK PSO-2
Los ensayos clínicos pivotales de fase 3 POETYK PSO-1 y POETYK PSO-2 evaluaron la seguridad y la eficacia de Sotyktu (6 mg una vez al día) en comparación con el placebo y Otezla (apremilast) (30 mg dos veces al día) en pacientes con psoriasis en placas de moderada a grave. Ambos fueron estudios de fase 3 de 52 semanas de duración, multinacionales, multicéntricos, aleatorizados, doble ciego, controlados con placebo y con un comparador activo. POETYK PSO-2 incluyó un retiro aleatorizado y un período de retratamiento después de la semana 24. En total, 664 pacientes se inscribieron en POETYK PSO-1 y 1020 pacientes en POETYK PSO-2. Todos los participantes tenían psoriasis en placas de moderada a grave y eran candidatos para fototerapia o terapia sistémica. Los pacientes tenían una afectación del área de superficie corporal de =10 por ciento, una puntuación del índice de gravedad y área de psoriasis (PASI) =12 y una evaluación global del médico (sPGA) estática =3 (moderada o grave).
Los criterios de valoración coprimarios de POETYK PSO-1 y POETYK PSO-2 fueron el porcentaje de pacientes que alcanzaron el Índice de gravedad y área de psoriasis de 75 y el porcentaje de pacientes que alcanzaron una puntuación estática de 0 o 1 en la Evaluación global del médico en la semana 16 frente a placebo . Los criterios de valoración secundarios clave incluyeron el porcentaje de pacientes que lograron PASI 75, PASI 90 y sPGA 0/1 en comparación con Otezla en la Semana 16 y la Semana 24.
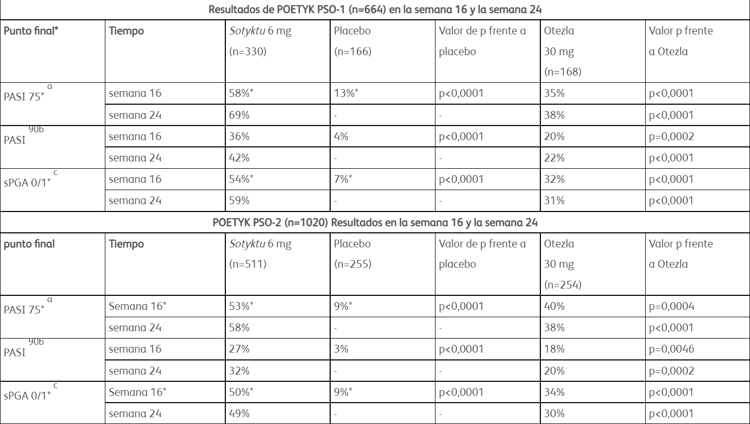
*Los criterios de valoración coprimarios para POETYK PSO-1 y POETYK PSO-2 fueron PASI 75 y sPGA 0/1 para Sotyktu frente a placebo en la semana 16.
a. PASI 75 se define como una mejora de al menos un 75 % con respecto al valor inicial en las puntuaciones del índice de gravedad y área de psoriasis (PASI).
b. PASI 90 se define como una mejora de al menos el 90 % con respecto al valor inicial en las puntuaciones del índice de gravedad y área de psoriasis (PASI).
C. sPGA 0/1 se define como una puntuación estática de evaluación global del médico (sPGA) de claro o casi claro.
Las respuestas persistieron hasta la semana 52, ya que el 82 % (187/228) de los pacientes que lograron PASI 75 con Sotyktu en la semana 24 mantuvieron su respuesta en la semana 52 en POETYK PSO-1. En POETYK PSO-2, el 80 % (119/148) de los pacientes que continuaron con Sotyktu mantuvieron una respuesta PASI 75 en comparación con el 31 % (47/150) de los pacientes que abandonaron Sotyktu .
Hasta la semana 16, se produjeron infecciones en el 29 % de los pacientes tratados con Sotyktu en comparación con el 22 % de los tratados con placebo. La mayoría de las infecciones no fueron graves y su gravedad fue de leve a moderada y no dieron lugar a la interrupción del tratamiento con Sotyktu . Se notificaron infecciones graves en cinco pacientes que recibieron Sotyktu y en dos pacientes tratados con placebo. Hasta la semana 52, las infecciones graves más comunes reportadas fueron neumonía y COVID-19. Se notificaron neoplasias malignas (excluido el cáncer de piel no melanoma) en tres pacientes tratados con Sotyktu .
Acerca de la psoriasis
La psoriasis es una enfermedad inmunomediada sistémica, crónica y de amplia prevalencia que deteriora sustancialmente la salud física, la calidad de vida y la productividad laboral de los pacientes. La psoriasis es un problema global grave, con al menos 100 millones de personas en todo el mundo afectadas por alguna forma de la enfermedad, incluidos aproximadamente 7,5 millones de personas en los EE . UUCasi una cuarta parte de las personas con psoriasis tienen casos que se consideran de moderados a moderados. severo. 3 Hasta el 90 por ciento de los pacientes con psoriasis tienen psoriasis vulgar, o psoriasis en placas, 6 que se caracteriza por placas redondas u ovaladas distintivas que generalmente están cubiertas por escamas de color blanco plateado.
Acerca de Sotyktu
Sotyktu (deucravacitinib) es un inhibidor alostérico selectivo de la tirosina quinasa 2 (TYK2). TYK2 es un miembro de la familia Janus kinase (JAK). Sotyktúse une al dominio regulador de TYK2, estabilizando una interacción inhibidora entre los dominios regulador y catalítico de la enzima. Esto da como resultado la inhibición alostérica de la activación mediada por el receptor de TYK2 y su activación aguas abajo de los transductores de señal y activadores de la transcripción (STAT), como se muestra en los ensayos basados en células. Janus quinasas funcionan como pares de homo o heterodímeros en las vías JAK-STAT. TYK2 se empareja con JAK1 para mediar en múltiples vías de citocinas y también se empareja con JAK2 para transmitir señales, como se muestra en los ensayos basados en células. Actualmente no se conoce el mecanismo preciso que vincula la inhibición de la enzima TYK2 con la eficacia terapéutica en el tratamiento de adultos con psoriasis en placas de moderada a grave.
Sotyktu está bajo revisión regulatoria por parte de la Asociación Médica Europea y otras autoridades sanitarias de todo el mundo para el tratamiento de la psoriasis en placas de moderada a grave y por parte del Ministerio de Salud, Trabajo y Bienestar de Japón para el tratamiento de adultos con placa de moderada a grave. psoriasis, psoriasis pustulosa y psoriasis eritrodérmica.
Indicaciones:
SOTYKTU™ (deucravacitinib) está indicado para el tratamiento de la psoriasis en placas de moderada a grave en adultos que son candidatos para terapia sistémica o fototerapia.
Limitaciones de uso:
No se recomienda el uso de SOTYKTU en combinación con otros inmunosupresores potentes.
Contraindicaciones
SOTYKTU está contraindicado en pacientes con antecedentes de reacción de hipersensibilidad al deucravacitinib o a cualquiera de los excipientes de SOTYKTU.
Advertencias y precauciones
Hipersensibilidad: Se han informado reacciones de hipersensibilidad como angioedema. Si se produce una reacción de hipersensibilidad clínicamente significativa, instaure el tratamiento adecuado y suspenda SOTYKTU.
Infecciones: SOTYKTU puede aumentar el riesgo de infecciones. Se han informado infecciones graves en pacientes con psoriasis que recibieron SOTYKTU. Las infecciones graves más comunes notificadas con SOTYKTU incluyeron neumonía y COVID-19. Evite el uso de SOTYKTU en pacientes con una infección activa o grave. Considere los riesgos y beneficios del tratamiento antes de iniciar SOTYKTU en pacientes:
-Con infección crónica o recurrente.
-Que han estado expuestos a la tuberculosis.
-Con antecedentes de una infección grave u oportunista.
-Con condiciones subyacentes que pueden predisponerlos a la infección.
Vigile de cerca a los pacientes para detectar el desarrollo de signos y síntomas de infección durante y después del tratamiento. Un paciente que desarrolla una nueva infección durante el tratamiento debe someterse a pruebas de diagnóstico rápidas y completas, iniciar una terapia antimicrobiana adecuada y ser monitoreado de cerca. Interrumpa SOTYKTU si un paciente desarrolla una infección grave. No reanude SOTYKTU hasta que la infección se resuelva o se trate adecuadamente.
Reactivación viral
La reactivación del virus del herpes (p. ej., herpes zoster, herpes simple) se informó en ensayos clínicos con SOTYKTU. Hasta la semana 16, se informaron infecciones por herpes simple en 17 pacientes (6,8 por 100 años-paciente) tratados con SOTYKTU y en 1 paciente (0,8 por 100 años-paciente) tratado con placebo. Se notificó herpes zóster multidermatomal en un paciente inmunocompetente. Durante PSO-1, PSO-2 y el ensayo de extensión abierto, la mayoría de los pacientes que informaron eventos de herpes zoster mientras recibían SOTYKTU tenían menos de 50 años. Se desconoce el impacto de SOTYKTU en la reactivación de la hepatitis viral crónica. Considere la detección de hepatitis viral y el control de la reactivación de acuerdo con las pautas clínicas antes de comenzar y durante la terapia con SOTYKTU. Si se presentan signos de reactivación, consulte a un especialista en hepatitis.
Tuberculosis (TB): En ensayos clínicos, de 4 pacientes con TB latente que fueron tratados con SOTYKTU y recibieron profilaxis antituberculosa adecuada, ningún paciente desarrolló TB activa (durante el seguimiento medio de 34 semanas). Un paciente, que no tenía TB latente, desarrolló TB activa después de recibir 54 semanas de SOTYKTU. Evalúe a los pacientes en busca de infección de TB latente y activa antes de iniciar el tratamiento con SOTYKTU. No administrar SOTYKTU a pacientes con TB activa. Iniciar el tratamiento de la TB latente antes de administrar SOTYKTU. Considere la terapia anti-TB antes de iniciar SOTYKTU en pacientes con antecedentes de TB latente o activa en quienes no se puede confirmar un curso de tratamiento adecuado. Supervise a los pacientes para detectar signos y síntomas de TB activa durante el tratamiento.
Neoplasia maligna, incluidos linfomas: Se observaron neoplasias malignas, incluidos linfomas, en ensayos clínicos con SOTYKTU. Considere los beneficios y riesgos para el paciente individual antes de iniciar o continuar la terapia con SOTYKTU, particularmente en pacientes con una neoplasia maligna conocida (aparte de un cáncer de piel no melanoma tratado con éxito) y pacientes que desarrollan una neoplasia maligna durante el tratamiento con SOTYKTU.
Rabdomiólisis y CPK elevada: El tratamiento con SOTYKTU se asoció con una mayor incidencia de elevación asintomática de la creatina fosfoquinasa (CPK) y rabdomiólisis en comparación con el placebo.
Descontinúe SOTYKTU si se presentan niveles de CPK marcadamente elevados o si se diagnostica o sospecha miopatía. Indique a los pacientes que notifiquen de inmediato el dolor, la sensibilidad o la debilidad musculares inexplicables, especialmente si se acompañan de malestar general o fiebre.
Anomalías de laboratorio: El tratamiento con SOTYKTU se asoció con aumentos en los niveles de triglicéridos. Evalúe periódicamente los triglicéridos séricos de acuerdo con las guías clínicas durante el tratamiento. El tratamiento con SOTYKTU se asoció con un aumento en la incidencia de elevación de las enzimas hepáticas en comparación con el placebo. Evalúe las enzimas hepáticas al inicio y posteriormente en pacientes con enfermedad hepática conocida o sospechada de acuerdo con el manejo de rutina. Si se producen aumentos de las enzimas hepáticas relacionados con el tratamiento y se sospecha una lesión hepática inducida por fármacos, interrumpir SOTYKTU hasta que se descarte un diagnóstico de lesión hepática.
Vacunas: antes de iniciar la terapia con SOTYKTU, considere completar todas las vacunas apropiadas para la edad de acuerdo con las pautas de vacunación actuales, incluida la vacunación profiláctica contra el herpes zoster. Evitar el uso de vacunas vivas en pacientes tratados con SOTYKTU. No se ha evaluado la respuesta a vacunas vivas o no vivas.
Riesgos potenciales relacionados con la inhibición de JAK: No se sabe si la inhibición de la tirosina quinasa 2 (TYK2) puede estar asociada con las reacciones adversas observadas o potenciales de la inhibición de la Janus Kinasa (JAK). En un gran ensayo aleatorizado de seguridad posterior a la comercialización de un inhibidor de JAK en la artritis reumatoide (AR), pacientes de 50 años de edad y mayores con al menos un factor de riesgo cardiovascular, tasas más altas de mortalidad por todas las causas, incluida la muerte cardiovascular súbita, reacciones adversas graves Se observaron eventos cardiovasculares, trombosis general, trombosis venosa profunda, embolia pulmonar y neoplasias malignas (excluido el cáncer de piel no melanoma) en pacientes tratados con el inhibidor de JAK en comparación con los tratados con bloqueadores del TNF. SOTYKTU no está aprobado para su uso en AR.
Reacciones adversas
Las reacciones adversas más comunes (=1 % de los pacientes con SOTYKTU y más frecuentes que con placebo) incluyen infecciones de las vías respiratorias superiores, aumento de la creatina fosfoquinasa en sangre, herpes simple, úlceras bucales, foliculitis y acné.
Poblaciones específicas
Embarazo: Los datos disponibles de los informes de casos sobre el uso de SOTYKTU durante el embarazo son insuficientes para evaluar el riesgo asociado con el fármaco de defectos congénitos importantes, aborto espontáneo o resultados maternos o fetales adversos. Informe los embarazos a la línea de notificación de eventos adversos de Bristol-Myers Squibb Company al 1-800-721-5072.
Lactancia: No hay datos sobre la presencia de SOTYKTU en la leche humana, los efectos en el lactante o los efectos en la producción de leche. SOTYKTU está presente en la leche de rata. Cuando una droga está presente en la leche animal, es probable que la droga esté presente en la leche humana. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de SOTYKTU de la madre y cualquier posible efecto adverso en el lactante a causa de SOTYKTU o de la afección materna subyacente.
Insuficiencia hepática: No se recomienda el uso de SOTYKTU en pacientes con insuficiencia hepática grave.
SOTYKTU está disponible en comprimidos de 6 mg.
Consulte la Información de prescripción completa de EE. UU. , incluida la Guía del medicamento , para SOTYKTU.
Acerca del soporte de acceso para pacientes de Bristol Myers Squibb
Bristol Myers Squibb mantiene su compromiso de brindar asistencia para que los pacientes que necesitan nuestros medicamentos puedan acceder a ellos y agilizar el tiempo de terapia.
Bristol Myers Squibb ofrece varios programas y recursos para apoyar el acceso a las terapias, incluido SOTYKTU, a través de nuestro programa SOTYKTU 360 SOPORTE. Para obtener información adicional, llame a SOTYKTU 360 SOPORTE al 1-888-SOTYKTU (1-888-768-9588) de 8 am a 11 pm ET, de lunes a viernes.
Acerca de Bristol Myers Squibb
Bristol Myers Squibb es una compañía biofarmacéutica global cuya misión es descubrir, desarrollar y ofrecer medicamentos innovadores que ayuden a los pacientes a superar enfermedades graves. Para obtener más información sobre Bristol Myers Squibb, visítenos en BMS.com o síganos en LinkedIn , Twitter , YouTube , Facebook e Instagram .
Otezla® ( apremilast ) es una marca registrada de Amgen Inc.
Declaración de precaución con respecto a las declaraciones prospectivas
Este comunicado de prensa contiene "declaraciones prospectivas" en el sentido de la Ley de Reforma de Litigios de Valores Privados de 1995 con respecto, entre otras cosas, a la investigación, el desarrollo y la comercialización de productos farmacéuticos. Todas las declaraciones que no sean declaraciones de hechos históricos son, o pueden considerarse, declaraciones prospectivas. Dichas declaraciones a futuro se basan en expectativas y proyecciones actuales sobre nuestros resultados, metas, planes y objetivos financieros futuros e involucran riesgos, suposiciones e incertidumbres inherentes, incluidos factores internos o externos que podrían retrasar, desviar o cambiar cualquiera de ellos en el próximo varios años, que son difíciles de predecir, pueden estar fuera de nuestro control y podrían causar que nuestros resultados financieros futuros, metas, planes y objetivos difieran materialmente de los expresados en, o implícito por, las declaraciones. Estos riesgos, suposiciones, incertidumbres y otros factores incluyen, entre otros, si SOTYKTU™ (deucravacitinib) tendrá éxito comercial, las aprobaciones de comercialización, si se otorgan, pueden tener limitaciones significativas en su uso y que la aprobación continua de SOTYKTU™ (deucravacitinib) puede depender de la verificación y descripción del beneficio clínico en los ensayos de confirmación. No se puede garantizar ninguna declaración prospectiva. Las declaraciones a futuro en este comunicado de prensa deben evaluarse junto con los muchos riesgos e incertidumbres que afectan el negocio y el mercado de Bristol Myers Squibb, particularmente aquellos identificados en la declaración de advertencia y la discusión de factores de riesgo en el Informe Anual de Bristol Myers Squibb en el Formulario 10-K para el año terminado el 31 de diciembre de 2021, según lo actualizado por nuestros informes trimestrales posteriores en el formulario 10-Q, informes actuales en el formulario 8-K y otras presentaciones ante la Comisión de Bolsa y Valores. Las declaraciones prospectivas incluidas en este documento se realizan solo a partir de la fecha de este documento y, salvo que la ley aplicable exija lo contrario, Bristol Myers Squibb no asume ninguna obligación de actualizar o revisar públicamente ninguna declaración prospectiva, ya sea como resultado de nueva información, eventos futuros, cambio de circunstancias o de otra manera.