Un estudio del CSIC descubre un mecanismo por el cual las células del estroma regulan el correcto desarrollo del epitelio mamario durante la pubertad.
Un estudio del CSIC descubre un mecanismo por el cual las células del estroma regulan el correcto desarrollo del epitelio mamario durante la pubertad.
Un equipo liderado por investigadores del Consejo Superior de Investigaciones Científicas (CSIC) ha descubierto que la disfunción de un gen clave para el correcto desarrollo de las mamas durante la pubertad predispone a la formación de tumores. El trabajo, llevado a cabo en ratones y publicado en Nature Communications, puede contribuir a la detección de dianas terapéuticas para el tratamiento del cáncer de mama.
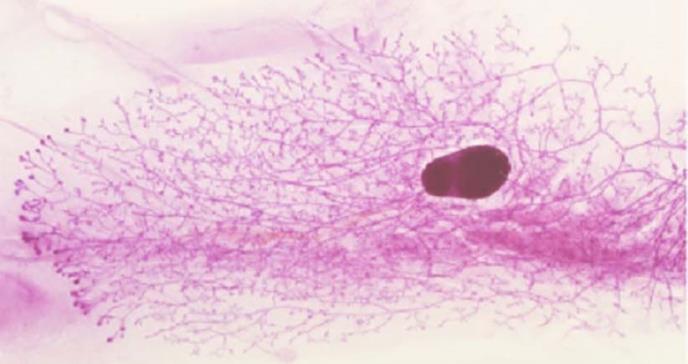
La glándula mamaria es uno de los pocos órganos que experimenta la mayor parte de su desarrollo después del nacimiento. El tejido de la mama está compuesto por dos compartimentos, el formado por los ductos mamarios, conductos epiteliales responsables de producir y transportar la leche durante la lactancia, y el estroma o tejido conectivo que los rodea. En la pubertad, una vez desarrollado, el tejido mamario permanece inactivo hasta el embarazo, momento en que volverá a producirse otro cambio: el crecimiento masivo y diferenciación de los alvéolos, que serán los encargados de secretar la leche durante la lactancia.
Los investigadores han descubierto un mecanismo por el cual las células del estroma regulan el correcto desarrollo del epitelio mamario durante la pubertad. Esta fase está controlada a nivel global por hormonas y a nivel local por la comunicación repetitiva y bidireccional entre el epitelio y el estroma.
“Este mecanismo de comunicacion entre las células epiteliales y estromales se basa en una serie de proteínas de señalización, denominadas ligandos Wnt, que son esenciales para el desarrollo de la mayor parte de los tejidos, pero que además están asociadas al desarrollo de muchos tipos de tumores en humanos”, explica el investigador del CSIC Fernando Martín-Belmonte, que trabaja en el Centro de Biología Molecular “Severo Ochoa” (CSIC-Universidad Autónoma de Madrid).
El estudio revela que el gen Sfrp3 modula la comunicación de las células epiteliales y el estroma a través de Wnt. Estas proteínas favorecen la proliferación y migración de estas células, pero su actividad es también necesaria para que se diferencien correctamente. “Todavía no comprendemos qué mecanismos son responsables de esta dualidad en las funciones de Wnt. Esto es esencial, ya que la desregulación de Wnt está asociada a muchos tipos de tumores”, añade el investigador del CSIC.
En el modelo animal con disfunción de Sfrp3, las células epiteliales muestran una proliferación aumentada, con características de pérdida de identidad funcional o polaridad y diferenciación anómala, lo que “demuestra que Sfrp3 funciona como un transportador extracelular de proteínas Wnt, de forma que controla su acumulación en el límite entre el epitelio y el estroma, modulando así la respuesta proliferativa y migratoria, así como la ramificación del epitelio durante el desarrollo de la mama”, destaca Martín-Belmonte.
La investigación, que ha contado con la colaboración de investigadores de la Comunidad de Madrid, demuestra que el uso de modelos animales de mama es clave para descifrar los mecanismos moleculares involucrados en su formación, homeostasis y transformación tumoral. “En la parte final del estudio, se caracterizó que la falta de Sfrp3 en modelos animales protumorales induce la aparición precoz de lesiones malignas, lo que sugiere un papel para Sfrp3 como marcador de susceptibilidad a la aparición de tumores en mama”, concluye el científico del CSIC.