Los pacientes que recibieron este fármaco experimentaron una mejora significativamente mayor desde el inicio respecto al cansancio.
La biofarmacéutica AbbVie anunció que la Administración Federal de Drogas y Alimentos de los Estados Unidos aprobó RINVOQ (upadacitinib; 15 mg una vez al día) en el tratamiento de adultos con artritis psoriásica activa, que han tenido una respuesta inadecuada o intolerancia a uno o más bloqueadores del factor de necrosis tumoral.
La aprobación de la FDA está sustentada en datos de dos estudios fundamentales (pivotal) de fase 3, SELECT-PsA 1 y SELECT-PsA 2, que evaluaron la eficacia, la seguridad y la tolerabilidad de RINVOQ en pacientes con APs2,3. En ambos estudios, el perfil de seguridad en pacientes con artritis psoriásica activa, tratados con 15 mg de RINVOQ que coincidió con el perfil de seguridad observado en pacientes con artritis reumatoide.
RINVOQ ayuda a mejorar el dolor, la hinchazón y la rigidez articular, al igual que el cansancio, y a prevenir un mayor daño articular en pacientes con artritis psoriásica activa.
“Esta nueva aprobación recalca nuestra misión de proveer una cartera de terapias que pueden ayudar a más personas con enfermedades reumáticas a lograr el control de la enfermedad”, explicó Michael Severino, M.D., vicedirector y presidente de AbbVie.
Entre los estudios clínicos de fase 3, RINVOQ alcanzó su criterio de valoración principal de ACR20 en la semana 12, en que los pacientes que tomaron 15 mg de RINVOQ lograron respuestas ACR20 significativamente más altas (71% y 57%, respectivamente) versus placebo (36% y 24%, respectivamente).
Los pacientes que recibieron 15 mg de RINVOQ experimentaron una mejora significativamente mayor desde el inicio respecto al cansancio, según medido por el puntaje de la Evaluación Funcional de Terapia de Enfermedad Crónica en la semana 12.
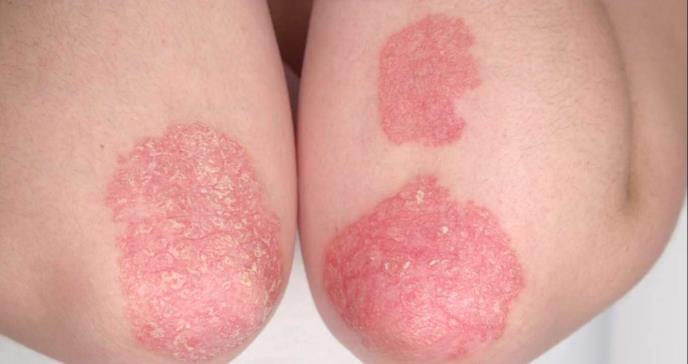
El tratamiento produjo una mejora en las manifestaciones cutáneas en pacientes con artritis psoriásica. Sin embargo, RINVOQ no se ha estudiado ni está indicado para el tratamiento de psoriasis en placas.
Durante el periodo controlado con placebo de 24 semanas de duración, los eventos adversos más comunes informados fueron infección del tracto respiratorio superior y elevaciones de los niveles séricos de creatina fosfocinasa.
Las frecuencias de herpes zóster y herpes simple con 15 mg de RINVOQ fueron 1.1% y 1.4%, respectivamente, con 15 mg de RINVOQ y 0.8% y 1.3%, respectivamente con placebo. Además, se observó una incidencia más alta de acné y bronquitis en pacientes tratados con 15 mg de RINVOQ (1.3% y 3.9%, respectivamente) en comparación con placebo (0.3% y 2.7%, respectivamente).
RINVOQ puede causar efectos secundarios graves como la reducción de la capacidad para combatir infecciones, aumento en el riesgo de muerte en personas de 50 años y mayores con al menos 1 factor de riesgo de enfermedad cardiaca, puede aumentar el riesgo de cánceres, aumento en el riesgo de eventos cardiovasculares, además pueden ocurrir coágulos sanguíneos en las venas de las piernas o los pulmones y las arterias.
Este es considerado como un hito que marca la segunda indicación aprobada por la FDA para RINVOQ después de artritis reumatoide en 2019.