Los pacientes tratados con tralokinumab de 300 mg en semanas alternas lograron una mejora del 75%.
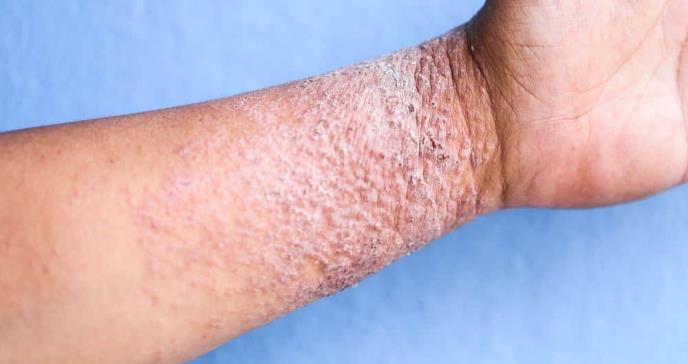
La Administración de Alimentos y Medicamentos (FDA) ha aprobado el tralokinumab para el tratamiento de la dermatitis atópica de moderada a grave en adultos cuya enfermedad no ha sido bien controlada con terapias tópicas recetadas o cuando esas terapias no son recomendables.
Administrado por vía subcutánea, el tralokinumab es un anticuerpo monoclonal (IgG4) que se une específicamente a la interleucina-13, un factor clave de la inflamación subyacente en la dermatitis atópica.
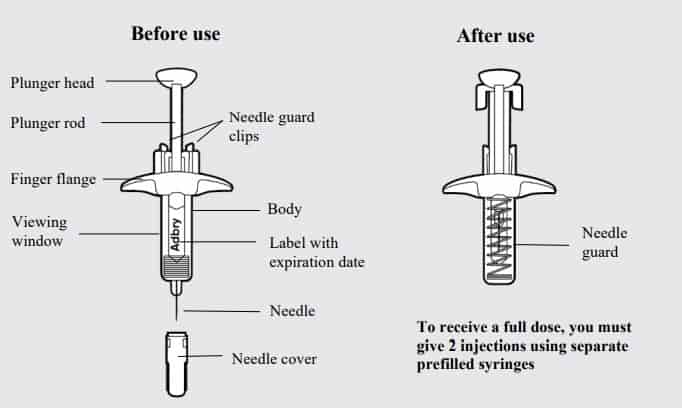
El medicamento, que ha sido desarrollado por la farmacéutica LEO Pharma, viene en una jeringa precargada de dosis única de 150 mg con un protector de aguja.
En dos ensayos pivotales (que ha conducido a la aprobación de un medicamento por la agencia reguladora y es la base de la ficha técnica) de fase 3 , ECZTRA 1 y ECZTRA 2 , la monoterapia con tralokinumab fue superior al placebo en la semana 16 para todos los criterios de valoración primarios y secundarios.
Por ejemplo, en la semana 16, para los ensayos de monoterapia ECZTRA 1 y 2, respectivamente, el 16% y el 21% de los pacientes tratados con tralokinumab 300 mg en semanas alternas lograron una piel más sana o casi clara (IGA 0/1) versus 7% y 9 % con placebo.
Además, el 25% y el 33% de los pacientes tratados con tralokinumab de 300 mg en semanas alternas lograron una mejora del 75% o más en la puntuación del índice de gravedad y área del eccema (EASI-75) frente al 13% y el 10% con placebo.
A las 52 semanas, el 51% y el 60% de los pacientes que respondieron en la semana 16 mantuvieron una respuesta IGA 0/1 con tralokinumab 300 mg en semanas alternas en ECZTRA 1 y 2, respectivamente.
Finalmente, el 60% y el 57% de los pacientes que respondieron en la semana 16 mantuvieron la respuesta EASI-75 con tralokinumab 300 mg en semanas alternas.
En el tercer ensayo fundamental del fármaco, ECZTRA 3 , los investigadores evaluaron la eficacia y seguridad de tralokinumab 300 mg en combinación con corticosteroides tópicos (TCS) según sea necesario en adultos con dermatitis atópica de moderada a grave que son candidatos para terapia sistémica.
Aplicación subcutánea con tralokinumab.
En la semana 16, el 38% de los pacientes tratados con tralokinumab 300 mg en semanas alternas más TCS lograron una piel clara o casi clara (IGA 0/1) frente al 27% con placebo más TCS.
Además, el 56% de los pacientes tratados con tralokinumab 300 mg en semanas alternas más TCS lograron una mejora del 75% o más en el EASI-75 frente al 37% con placebo más TCS. A las 32 semanas, el 89% y el 92% de los pacientes que respondieron en la semana 16 mantuvieron la respuesta (IGA 0/1 y EASI-75, respectivamente) con tralokinumab 300 mg en semanas alternas.
Puede encontrar un enlace a la información de prescripción del medicamento aquí.
Por Mdedge Dermatology.
Referencia:
Brunk, D. (2021, 28 diciembre). FDA gives nod to tralokinumab for adults with moderate to severe AD. Mdedge Dermatology. https://www.mdedge.com/dermatology/article/250288/atopic-dermatitis/fda-gives-nod-tralokinumab-adults-moderate-severe-ad