El retiro afecta a cápsulas de 1, 2 y 5 mg de 55 lotes fabricados por Teva Pharmaceuticals USA y está clasificado como "Clase II", indicando bajo riesgo de consecuencias graves, aunque el uso del producto podría causar efectos temporales o reversibles.
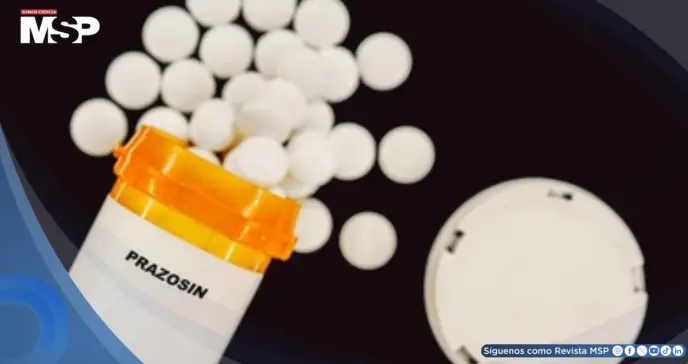
La Administración de Alimentos y Medicamentos (FDA) de Estados Unidos ha ordenado el retiro voluntario de más de 580,000 frascos de Prazosin Hydrochloride, un medicamento ampliamente utilizado para tratar la hipertensión arterial.
La medida preventiva se tomó después de que los controles de calidad detectaran niveles superiores a los permitidos de una impureza clasificada como potencialmente cancerígena.
El retiro, anunciado inicialmente el 7 de octubre y oficializado el 24 del mismo mes, afecta a las cápsulas de 1, 2 y 5 miligramos fabricadas por Teva Pharmaceuticals USA. La empresa ha cooperado con las autoridades sanitarias en este proceso que busca proteger a miles de pacientes que utilizan este fármaco para controlar su presión arterial.
El problema se centra en la presencia de N-nitroso Prazosin impurity C, una nitrosamina que las autoridades sanitarias monitorizan estrechamente por su potencial carcinogénico. Este compuesto puede generarse durante los procesos de producción o almacenamiento de algunos medicamentos.
La FDA ha clasificado este retiro como "Clase II", lo que significa que aunque el uso del producto podría causar efectos adversos temporales o clínicamente reversibles, la probabilidad de consecuencias graves para la salud se considera baja. Hasta el momento, según la información disponible, "hasta el momento no se han recibido quejas relevantes ligadas a la calidad o los efectos del producto retirado".
El Prazosin Hydrochloride pertenece a la clase de medicamentos conocidos como alfa-bloqueantes, prescritos principalmente para el tratamiento de la hipertensión arterial. En algunos casos, también se utiliza para manejar ciertos síntomas asociados al trastorno de estrés postraumático.
El retiro afecta específicamente a 55 lotes diferentes distribuidos en envases que contienen desde 100 hasta 1,000 cápsulas, todos ellos comercializados exclusivamente en territorio estadounidense. La FDA ha publicado en su sitio web oficial la lista completa de los números de lote y fechas de vencimiento involucrados.
Las autoridades sanitarias enfatizan que los pacientes que estén tomando este medicamento no deben suspender su tratamiento por cuenta propia. La recomendación oficial es consultar con su médico o farmacéutico para verificar si su medicación pertenece a alguno de los lotes retirados y, en ese caso, recibir orientación sobre alternativas terapéuticas disponibles.
Existen múltiples opciones para controlar la presión arterial, y los profesionales de la salud pueden indicar la más adecuada para cada caso particular. Las farmacias ya han sido notificadas formalmente y están procediendo a retirar de la venta todos los productos afectados.
Este caso se enmarca en una tendencia más amplia de intensificación de controles sobre nitrosaminas en medicamentos. Desde 2018, la FDA ha reforzado su monitorización de estas sustancias en diversos productos farmacéuticos, especialmente en aquellos de consumo masivo para enfermedades crónicas.
En meses recientes, se han producido retiros similares de otros medicamentos, incluyendo algunos lotes de medicamentos para el colesterol, reflejando una política de mayor rigor en los estándares de calidad y seguridad farmacéutica.
Las autoridades mantienen abiertos sus canales de notificación y continúan procesando información sobre lotes sospechosos en coordinación con las empresas fabricantes, con el objetivo de prevenir potenciales riesgos para la salud pública.