La migración y la correcta organización de estas células en las primeras etapas del desarrollo embrionario son cruciales para la formación adecuada de la cara y otras partes del cuerpo.
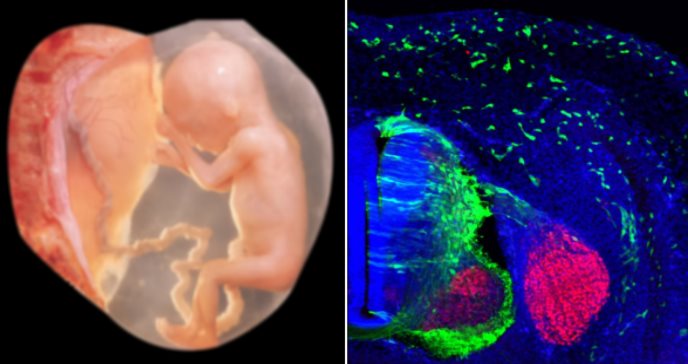
Un equipo internacional coliderado por el Instituto de Neurociencias de Alicante (IN), centro mixto del CSIC y la Universidad Miguel Hernández (UMH), ha realizado un descubrimiento sobre los mecanismos genéticos que regulan el desarrollo craneofacial.
El estudio, publicado en The American Journal of Human Genetics, ha identificado el papel esencial del gen ZIC2 y del complejo ARID1A-BAF en la migración celular de la cresta neural, un proceso fundamental para la formación de la estructura facial durante el desarrollo embrionario.
El estudio ha identificado un mecanismo genético fundamental en el que el gen ZIC2, en colaboración con el complejo ARID1A-BAF, juega un papel esencial en un proceso clave conocido como transición epitelio-mesénquima (EMT).
Este proceso permite que las células cambien de forma y migren a áreas específicas del embrión para formar órganos y tejidos, incluyendo las estructuras del craneo y faciales.
La migración y la correcta organización de estas células en las primeras etapas del desarrollo embrionario son cruciales para la formación adecuada de la cara y otras partes del cuerpo.
Sin embargo, cuando el gen ARID1A no funciona correctamente, como ocurre en ciertas enfermedades genéticas, el gen ZIC2 no puede activar los genes necesarios para que las células de la cresta neural migratorias se desplacen adecuadamente.
Esto interrumpe la migración celular, causando trayectorias celulares anormales que derivan en defectos craneofaciales y otras malformaciones.
Para estudiar este proceso, los investigadores utilizaron células madre derivadas de pacientes con síndrome de Coffin-Siris (CSS), un trastorno genético raro que se caracteriza por malformaciones craneofaciales, retraso intelectual, y otras anomalías en diversas partes del cuerpo.
Este síndrome ocurre cuando hay deficiencia en la función de genes como ARID1A, lo que interfiere con la migración celular normal. A través de avanzadas técnicas como RNA-seq y ChIP-seq, los científicos pudieron identificar los genes regulados por el eje molecular ARID1A-ZIC2 y cómo su alteración afecta la migración celular en el desarrollo de las estructuras faciales.
Los investigadores también utilizaron modelos animales, como ratones y embriones de pollo, para observar en vivo cómo ZIC2 regula la migración de las células de la cresta neural, y cómo la pérdida de ARID1A afecta este proceso.
Este enfoque experimental permitió confirmar que ZIC2 se expresa en las células premigratorias de la cresta neural justo antes de que estas comiencen a migrar hacia sus destinos, lo que destaca aún más la importancia de este gen en el desarrollo craneofacial.
El hallazgo permite entender las bases genéticas de las malformaciones craneofaciales y puede abrir nuevas oportunidades para el desarrollo de tratamientos dirigidos a corregir defectos genéticos en enfermedades congénitas.
Según la profesora Eloísa Herrera, líder del estudio, "Conocer cómo interactúan ZIC2 y ARID1A en el desarrollo nos da una herramienta clave para explorar posibles tratamientos en enfermedades genéticas congénitas".
Este conocimiento podría ser utilizado en el futuro para diseñar terapias personalizadas que corrijan o mitigan los defectos causados por la disfunción de estos genes.
Entender los mecanismos genéticos involucrados en la migración celular durante el desarrollo temprano también podría ayudar a comprender mejor otras afecciones genéticas y enfermedades relacionadas con la migración celular, y potencialmente ofrecer nuevas vías para la medicina regenerativa y tratamientos personalizados.
Fuente consultada aquí.