Los estudios clínicos PURSUIT demostraron resultados de eficacia y seguridad, con una remisión clínica alcanzada en el 32% de los pacientes a la semana 6 y mantenida en más de la mitad hasta la semana 54, lo que respalda su uso a largo plazo.
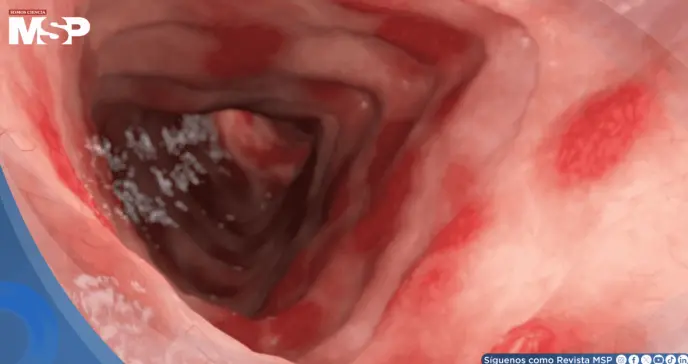
La Administración de Alimentos y Medicamentos de EE. UU. (FDA) aprobó el uso del fármaco SIMPONI® (golimumab) para el tratamiento de niños y adolescentes con colitis ulcerosa activa de moderada a grave.
La decisión, anunciada por Johnson & Johnson, beneficiará a pacientes pediátricos con un peso mínimo de 15 kilogramos.
Esta autorización amplía el uso de un medicamento que ya estaba disponible para adultos y sería una nueva opción para una población con alternativas limitadas, donde la colitis ulcerosa afecta a más de un millón de estadounidenses, de los cuales aproximadamente el 20% son pacientes pediátricos.
La aprobación se convierte en una esperanza para el manejo de una condición compleja. Hasta ahora, existían pocas terapias autorizadas específicamente para los más jóvenes.
"La colitis ulcerosa es una enfermedad compleja y crónica, cuyo manejo eficaz suele ser difícil, especialmente en pacientes pediátricos, donde existen relativamente pocas opciones aprobadas", afirmó el Dr. Chris Gasink, vicepresidente de Asuntos Médicos, Gastroenterología y Autoanticuerpos de Johnson & Johnson Innovative Medicine.
"La aprobación de SIMPONI representa un hito significativo, ya que ofrece una terapia con eficacia y seguridad bien establecidas, junto con la administración subcutánea, para pacientes más jóvenes, cuyas opciones de tratamiento históricamente han sido limitadas", añadió.
La decisión de la FDA se sustenta en los resultados del programa de investigación PURSUIT, que incluyó dos estudios multicéntricos en población pediátrica. Los datos de eficacia y seguridad resultaron clave para la autorización.
En el estudio de fase 3 PURSUIT 2, el objetivo principal de remisión clínica en la semana 6 se logró en el 32% de los pacientes tratados con SIMPONI®. Además, se observaron mejorías en otros indicadores clave: el 58% mostró una respuesta clínica a las seis semanas, y el 40% logró una mejoría endoscópica.
La duración del efecto también fue alentadora. Entre los pacientes que alcanzaron la remisión clínica inicial, más de la mitad (57%) la mantuvieron hasta la semana 54. El perfil de seguridad observado en niños fue consistente con el ya conocido en adultos.
Una de las características que destaca este tratamiento es su esquema de dosificación. SIMPONI® se administra por vía subcutánea con una jeringa precargada, lo que permite la autoadministración en pacientes mayores de 12 años que hayan recibido la capacitación adecuada.
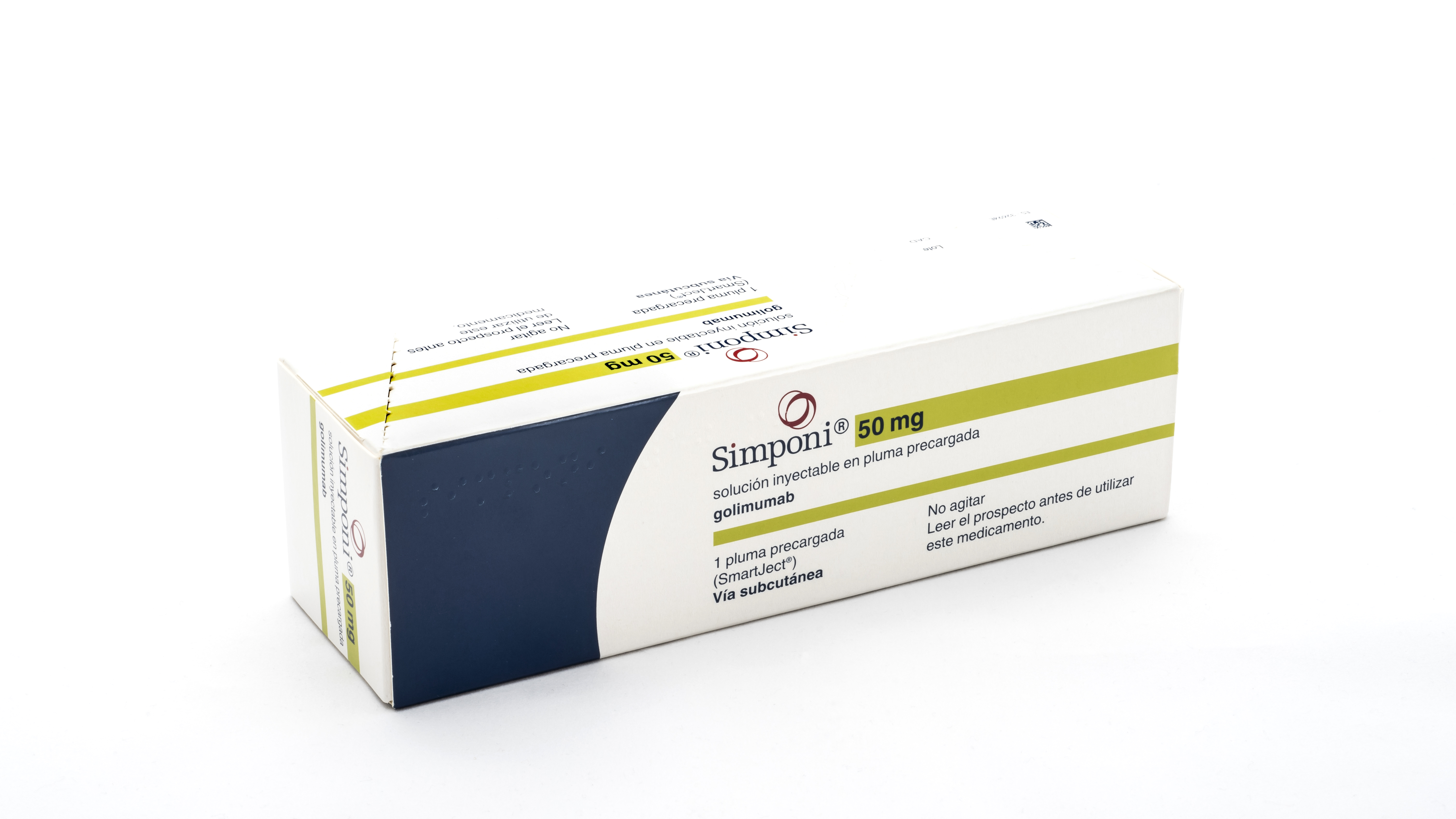
El régimen de dosificación varía según el peso del paciente:
Para niños que pesan 40 kg o más: una dosis inicial de 200 mg en la semana 0, seguida de 100 mg en las semanas 2 y 6, y luego cada 4 semanas.
Para niños con un peso entre 15 kg y menos de 40 kg: una dosis inicial de 100 mg en la semana 0, seguida de 50 mg en las semanas 2 y 6, y posteriormente cada 4 semanas.
Este esquema convierte a SIMPONI® en el único tratamiento aprobado que ofrece una dosis de mantenimiento mensual para esta población pediátrica, simplificando potencialmente su manejo a largo plazo.
Esta es la primera aprobación pediátrica para SIMPONI®, que ya contaba con cuatro indicaciones para enfermedades inmunomediadas en adultos: artritis reumatoide, artritis psoriásica, espondilitis anquilosante y la propia colitis ulcerosa.