El ameloblastoma periférico es un tumor odontogénico benigno poco común que surge en los tejidos blandos de la mucosa oral. Presentamos 2 casos en el reborde alveolar mandibular, ambos como masas exofíticas, firmes e indoloras.
El ameloblastoma periférico es una variante extraósea rara del ameloblastoma convencional, caracterizada por su desarrollo exclusivo en tejidos blandos gingivales sin afectación ósea inicial.
Su presentación clínica mimética frecuentemente simula patologías benignas comunes, retrasando el diagnóstico y complicando el manejo terapéutico.
Estos dos casos dejan en evidencia las particularidades de esta entidad en pacientes geriátricos: el primero sugiere una recurrencia en tejidos blandos de un ameloblastoma intraóseo previamente tratado, mientras el segundo es una lesión primaria de crecimiento lingual silente.
Ambos enfatizan la necesidad de un abordaje multidisciplinario que integre hallazgos clínicos y análisis histopatológico para lograr un diagnóstico preciso y un tratamiento adecuado.
Una paciente septuagenaria se presentó en el Departamento de Cirugía Oral y Maxilofacial de la Facultad de Odontología MES de Kerala con una tumoración en la región edéntula posterior inferior derecha.
Con antecedentes de edentulismo parcial de una década y uso de prótesis removible, la paciente refirió el inicio de la sintomatología hace tres años, asociada al uso de una prótesis mal adaptada.
Previamente había sido diagnosticada con ameloblastoma folicular y tratada mediante enucleación con curetaje, sin recibir terapia adyuvante. La recurrencia se manifestó dos meses antes de la consulta actual.
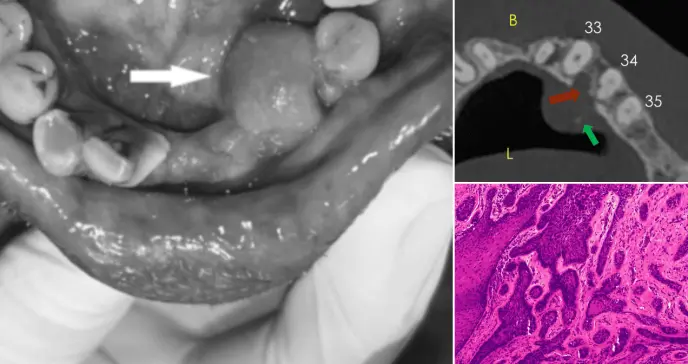
La exploración evidenció una lesión sésil, firme y asintomática de 1 cm³ en el reborde alveolar de caninos y premolares derechos, con mucosa superficial intacta y ausencia de ulceración. La tomografía computarizada de haz cónico (CBCT) mostró un defecto quirúrgico residual sin signos de erosión ósea ni disrupción cortical, descartando invasión ósea aparente.
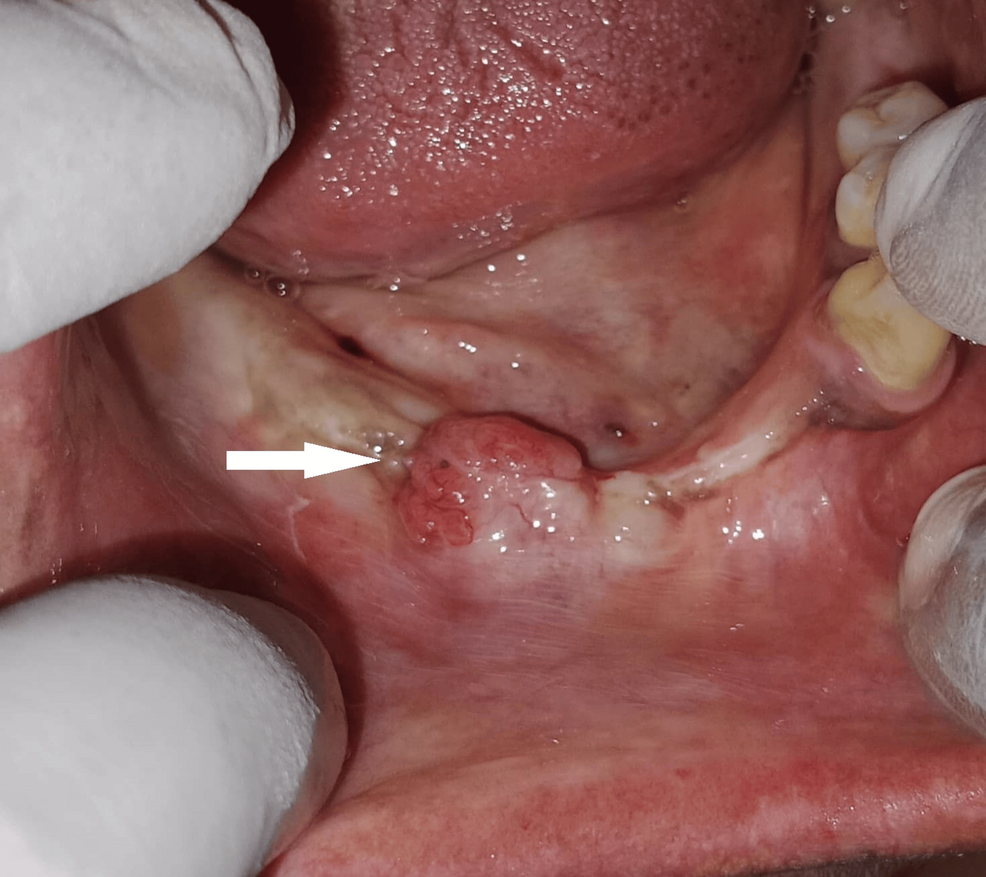
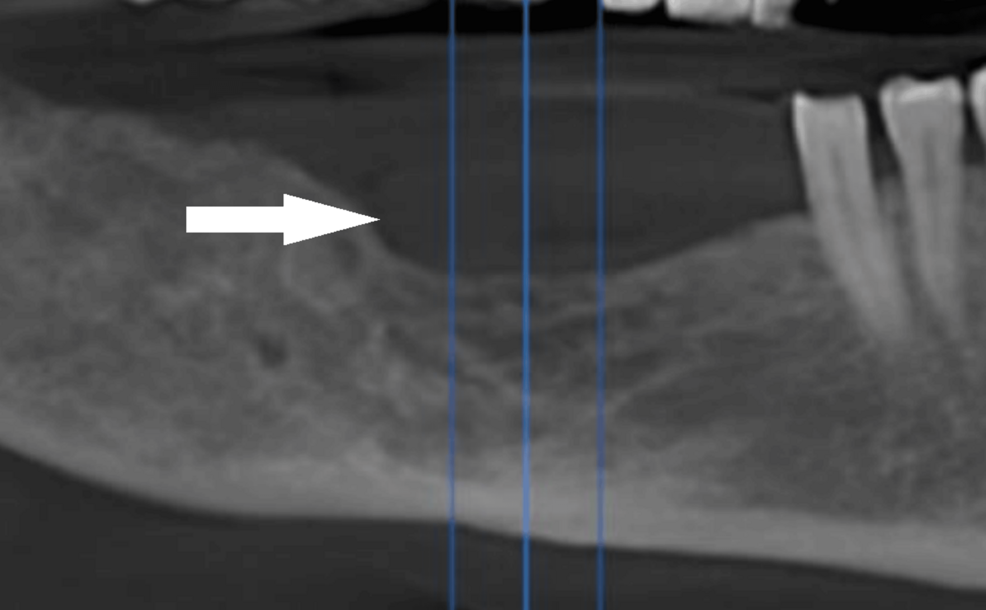
Figura 2: Reconstrucción panorámica a partir de CBCT que muestra una cresta intacta y un defecto quirúrgico en el sitio de enucleación anterior.
CBCT, tomografía computarizada de haz cónico.
La biopsia escisional bajo anestesia local reveló características microscópicas diagnósticas: epitelio escamoso ulcerado de superficie papilar que cubría tejido conectivo fibrovascular, con islotes epiteliales odontogénicos mostrando células basales hipercromáticas en empalizada periférica y células reticulares estrelladas centrales con áreas de metaplasia escamosa.
Estas confirmaron ameloblastoma periférico tipo folicular. El seguimiento a los 3 y 7 meses postoperatorios no mostró recurrencia.
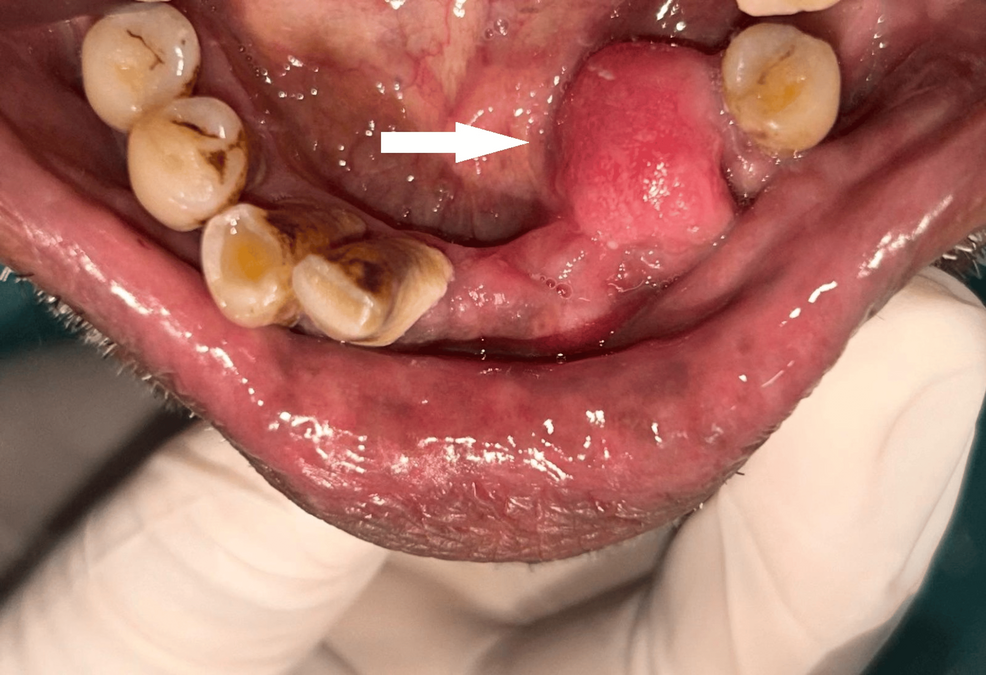
Un paciente de 75 años con antecedentes de asma controlada acudió por dolor sordo intermitente en región premolar inferior izquierda de un mes de evolución, asociado a una tumoración indolora de un año de progresión. La exploración intraoral identificó una masa de 3 cm³ en la cara lingual de canino y premolares inferiores izquierdos, con mucosa superficial lisa y ausencia de signos inflamatorios agudos.
La CBCT demostró una lesión de tejidos blandos en la región lingual desde incisivos laterales hasta segundos premolares, con erosión cortical lingual entre canino y primer premolar. La presencia de focos hiperdensos intralesionales sugirió restos corticales, islotes óseos o calcificaciones distróficas.
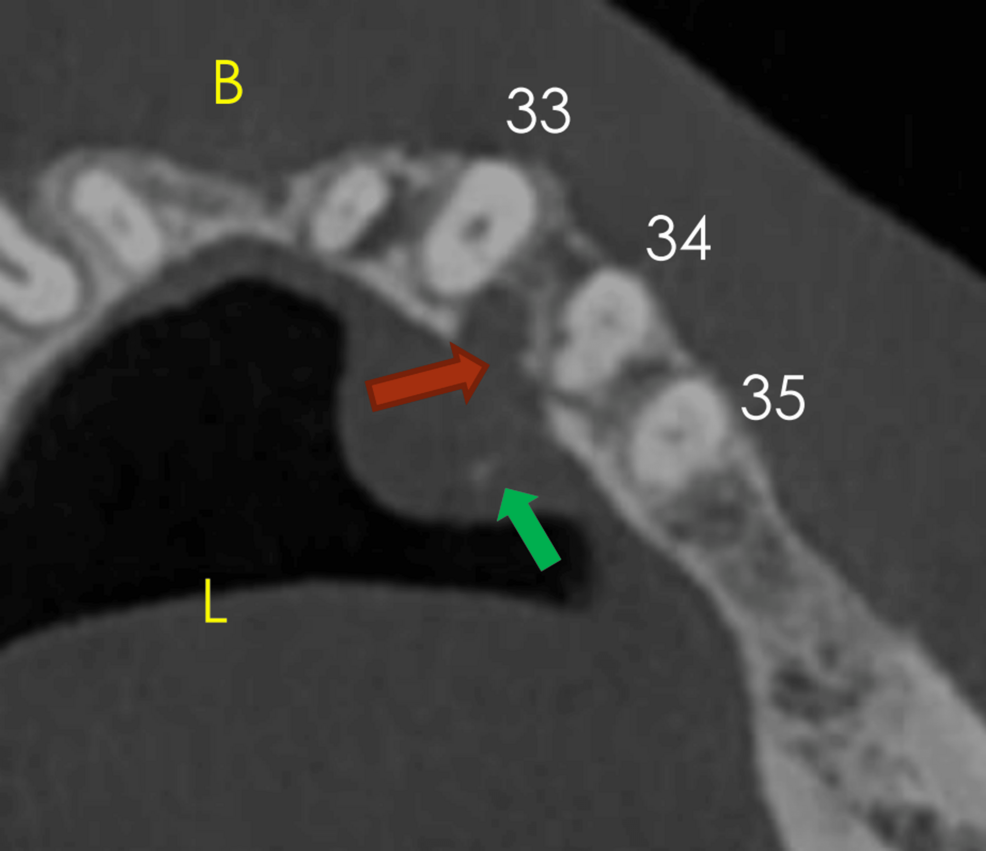
CBCT, tomografía computarizada de haz cónico.
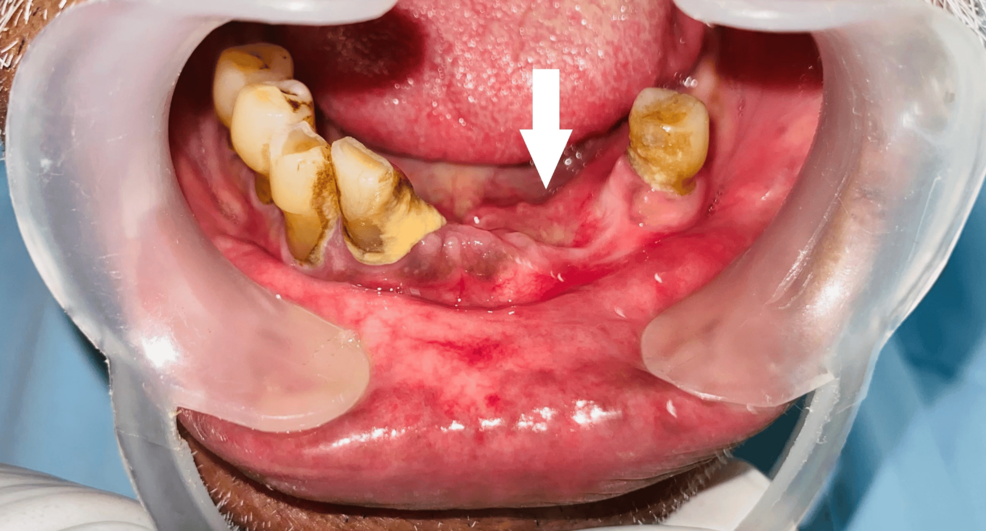
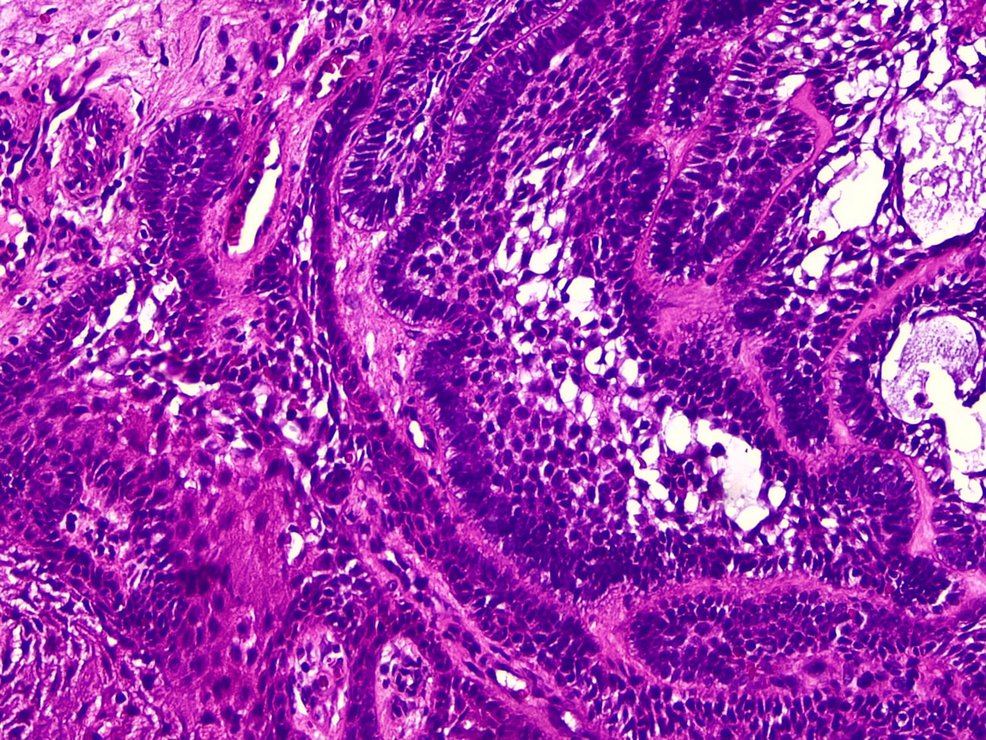
La biopsia incisional identificó un ameloblastoma periférico tipo acantomatoso, caracterizado por islotes y cordones epiteliales odontogénicos con células basales en empalizada, células estrelladas centrales y extensa metaplasia escamosa, en un estroma con hialinización focal.
Se realizó escisión local amplia, con seguimiento a los 3 y 6 meses sin evidencia de recidiva.
El ameloblastoma periférico (AP) constituye una variante extraósea excepcional, representando solo entre el 1% y 10% de todos los ameloblastomas. Según los autores (SA, AR, CS, et al.), su rareza y similitud morfológica con lesiones gingivales reactivas como épulis fibroso, granuloma periférico de células gigantes o granuloma piógeno frecuentemente retrasan el diagnóstico correcto.
Esta similitud clínica representa un desafío significativo en la toma de decisiones terapéuticas iniciales, subrayando la importancia de la confirmación histopatológica sistemática.
El AP muestra predilección por la encía lingual en la región premolar mandibular, con un rango etario amplio (16-92 años). Se presenta típicamente como masa sésil o pediculada de superficie lisa, granular o papilar, como evidenciaron nuestros casos en región edéntula mandibular.
Radiológicamente, aunque generalmente preserva la integridad ósea, puede exhibir reabsorción por presión ("excavación" ósea), destacando la necesidad indispensable de imágenes tridimensionales mediante CBCT o TC para evaluar profundidad de invasión y descartar afectación ósea subyacente.
Histológicamente, el AP replica los patrones del ameloblastoma central, predominando las variantes folicular y acantomatosa con empalizada periférica característica y polaridad nuclear invertida.
El origen multifocal posible incluye restos de lámina dental, células basales epiteliales o ductos salivales menores, explicando reportes en localizaciones atípicas como mucosa bucal, suelo de boca e incluso fosa infratemporal. Molecularmente, las mutaciones en la vía MAPK (especialmente BRAF V600E, presente en ˜62% de casos) ofrecen perspectivas terapéuticas promisorias para casos avanzados o recurrentes.
La escisión completa con márgenes adecuados representa el gold standard terapéutico. Las tasas de recurrencia (9-20%) son inferiores a las del ameloblastoma intraóseo pero justifican seguimiento prolongado. La transformación maligna es excepcional (<1%) pero posible.
La distinción entre AP de novo y recurrencia en tejidos blandos de ameloblastoma intraóseo previo -como posiblemente ocurrió en nuestro Caso 1- tiene implicaciones pronósticas cruciales, requiriendo evaluación molecular comparativa cuando sea posible.
La imposibilidad de realizar análisis molecular comparativo entre la lesión inicial y la recurrente en nuestro Caso 1 limita la clasificación definitiva. Avances en terapias dirigidas contra mutaciones BRAF V600E (dabrafenib, vemurafenib, trametinib) ofrecen alternativas para casos irresecables o metastásicos, aunque su uso permanece principalmente en ámbito investigacional.