La paciente presentó una insuficiencia cardíaca con fracción de eyección preservada y un corazón marcadamente engrosado, acompañada de un electrocardiograma de bajo voltaje y la presencia de una proteína monoclonal asociada a mieloma múltiple.
Una mujer de 71 años con antecedentes de hipertensión, diabetes y cáncer de mama, llegó a urgencias por dificultad para respirar al realizar esfuerzos, que había empeorado en las últimas dos semanas.
Al examinarla, los médicos encontraron signos claros de insuficiencia cardíaca congestiva: distensión de las venas del cuello y edema (hinchazón) en ambas piernas. Los análisis de sangre mostraban niveles muy elevados de péptidos que indican estrés cardíaco (BNP), signos de posible coagulación anormal (dímero D alto) y daño en las células del corazón (troponina elevada). Estas señales encendieron las alarmas.
Un corazón engrosado y un hallazgo inesperado en la sangre
Los estudios iniciales para entender la causa de su falla cardíaca arrojaron resultados peculiares. El electrocardiograma mostraba un patrón de bajo voltaje y signos de un posible infarto antiguo.
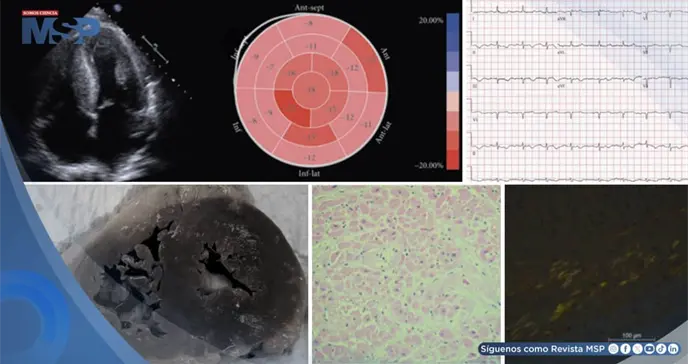
Sin embargo, el ecocardiograma (ecografía del corazón) reveló una función de bombeo preservada, pero con un grave engrosamiento de las paredes del corazón (hipertrofia ventricular izquierda) y un patrón de llenado anormal, lo que sugería que el músculo cardíaco estaba rígido, posiblemente por una enfermedad infiltrativa.
Paralelamente, otros exámenes de sangre descubrieron niveles elevados de calcio y, lo más importante, la presencia de una proteína monoclonal anormal (IgG lambda) en cantidades muy altas.
Este "pico monoclonal" es una bandera roja para una discrasia de células plasmáticas, como el mieloma múltiple, un cáncer de la sangre. Una biopsia de médula ósea confirmó este diagnóstico, mostrando que el 40% de sus células eran plasmáticas, compatibles con mieloma. También se encontraron lesiones óseas.
La paciente fue dada de alta con tratamiento para la insuficiencia cardíaca y la instrucción de continuar estudios especializados del corazón. Sin embargo, una semana después su condición se deterioró catastróficamente.
Fue readmitida con insuficiencia respiratoria progresiva, fiebre, síncope (desmayo), y signos de falla renal y hepática aguda. Sus marcadores de estrés y daño cardíaco se habían disparado aún más.
La situación se volvió crítica cuando desarrolló una arritmia ventricular maligna e inestable (taquicardia ventricular polimórfica), un ritmo cardíaco caótico que impide que el corazón bombee sangre.
A pesar de los esfuerzos de reanimación y de múltiples intentos con medicamentos antiarrítmicos, desfibrilación y soporte avanzado, la arritmia persistió. La familia, ante la falta de respuesta a las terapias, tomó la difícil decisión de suspender los esfuerzos de reanimación.
La autopsia brindó las respuestas definitivas que la evolución clínica acelerada no permitió obtener en vida. Reveló un corazón agrandado e hipertrificado. El hallazgo crucial vino de la tinción especial con rojo Congo del tejido cardíaco y hepático, que mostró depósitos de una proteína anormal llamada amiloide, con la clásica birrefringencia verde manzana bajo luz polarizada.
Un análisis patológico externo confirmó que se trataba de amiloidosis de cadena ligera (AL), una enfermedad rara donde células plasmáticas anormales (como las del mieloma) producen proteínas que se pliegan mal, forman fibrillas y se depositan en órganos, en este caso, infiltrando y destruyendo el corazón.
La amiloidosis cardíaca AL es una enfermedad grave donde proteínas amiloides anómalas, producidas por un trastorno de células plasmáticas (como el mieloma), se acumulan en el tejido del corazón. Esta infiltración hace que el músculo cardíaco se vuelva rígido, llevando a una miocardiopatía restrictiva que dificulta el llenado del corazón y eventualmente afecta su capacidad para bombear.
Se presenta con síntomas de insuficiencia cardíaca como dificultad para respirar y edema, y es notoria por causar arritmias tanto auriculares como ventriculares peligrosas, tal como ocurrió en este caso.
Diagnosticar la amiloidosis cardíaca requiere integrar los hallazgos de múltiples pruebas, ya que a menudo imita otras condiciones cardiacas más comunes. El electrocardiograma suele mostrar un patrón desconcertante de bajo voltaje, donde las ondas eléctricas son anormalmente pequeñas a pesar de que el ecocardiograma revela un corazón claramente engrosado.
Esta discordancia es una pista diagnóstica clave. El ecocardiograma, por su parte, es fundamental y muestra un engrosamiento concéntrico del ventrículo, una textura granular particular del músculo y un patrón característico de movimiento llamado "apical sparing" o "cereza en la cima", donde la punta del corazón se mueve mejor que sus paredes basales.
Según los autores (Adithya T. Mathews et al), el manejo de la amiloidosis cardíaca AL es doble y exige una coordinación estrecha entre cardiólogos y hematólogos u oncólogos. Por un lado, es imperativo tratar la enfermedad de base, es decir, el trastorno de células plasmáticas subyacente.
Esto se logra con terapias dirigidas como quimioterapia, inmunoterapia o, en pacientes seleccionados, con un trasplante autólogo de células madre, con el objetivo de detener la producción de las proteínas amiloides tóxicas. Por otro lado, se debe manejar de manera simultánea y agresiva las consecuencias cardiacas de la enfermedad.
Esto implica controlar los síntomas de la insuficiencia cardíaca, a menudo con diuréticos y un uso muy cuidadoso de ciertos medicamentos cardiacos estándar, y abordar las arritmias, que pueden requerir fármacos especializados, desfibriladores automáticos implantables o marcapasos. En casos muy específicos y detectados en etapas tempranas, incluso se puede contemplar la opción de un trasplante cardíaco.
Este trágico caso subraya la importancia crítica de considerar la amiloidosis cardíaca AL en el diagnóstico diferencial de pacientes, especialmente mayores, que presenten una constelación particular de signos. Esta sospecha debe surgir ante una insuficiencia cardíaca con función de bombeo preservada pero con un engrosamiento ventricular inexplicable en el ecocardiograma.
Debe fortalecerse al encontrar la discordancia entre un electrocardiograma de bajo voltaje y un corazón grueso en las imágenes. Y se vuelve imperativa cuando existe un diagnóstico concomitante de mieloma múltiple o cualquier otra gammapatía monoclonal. La sospecha temprana, seguida de la realización oportuna de pruebas de imágenes especializadas y la confirmación histológica, son eslabones cruciales.
Un diagnóstico a tiempo es la única puerta de entrada a terapias dirigidas que, aunque complejas, representan la posibilidad de modificar el curso de esta enfermedad que compromete gravemente la vida al infiltrar y dañar el corazón de manera silenciosa pero implacable.