La mayoría de los pacientes con síndromes mielodisplásicos (MDS) tienen anemia macrocítica o normocítica como resultado de una eritropoyesis ineficaz debido a la hematopoyesis clonal.
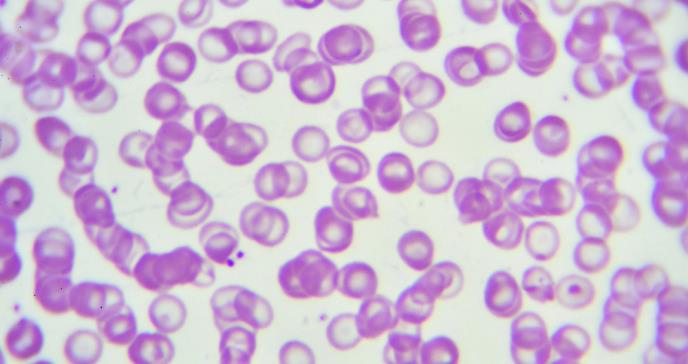
Los pacientes ocasionales con MDS tienen índices de glóbulos rojos (RBC) microcíticos en ausencia de deficiencia de hierro, y una alta proporción de estas personas tienen expresión disminuida de globina alfa asociada con mutaciones somáticas en el factor de remodelación de la cromatina ATRX; un mecanismo alternativo establecido para la talasemia alfa adquirida en la neoplasia mieloide es la eliminación clonal del grupo de globina alfa en el cromosoma 16p. Este fenómeno clinicopatológico se ha denominado “síndrome mielodisplásico-alfa talasemia adquirida” (ATMDS).
Los estudios de correlación fenotipo-genotipo pueden revelar asociaciones de patrones de mutación específicos con otros hallazgos hematológicos recurrentes asociados con SMD.
Los trastornos humanos más comunes de la síntesis de hemoglobina son las talasemias alfa y beta hereditarias, endémicas de las regiones tropicales y subtropicales del mundo, y que resultan de mutaciones, reordenamientos o deleciones de la línea germinal de los grupos de genes de globina y sus elementos reguladores que actúan en cis. También se ha descrito talasemia adquirida, principalmente alfa talasemia debido a mutaciones puntuales somáticas en un factor regulador que actúa en trans, ATRX, o, con menos frecuencia, debido a deleciones del grupo de genes de globina alfa en el cromosoma 16 como parte de la inestabilidad clonal de mieloide. neoplasia.
Las mutaciones adquiridas de ATRX, un factor asociado a la cromatina ligado al cromosoma X que tiene efectos distintos en la expresión génica de las globinas alfa y beta, se observan con mayor frecuencia en el contexto de los síndromes mielodisplásicos (MDS).1 A diferencia de la alfa-talasemia-MDS (ATMDS, Online Mendelian Inheritance in Man #300448), los casos de MDS con beta talasemia adquirida son extremadamente raros y mal caracterizados.
Las alteraciones hereditarias en la expresión de los genes de la globina beta se asocian con un amplio espectro de presentaciones clínicas, desde un rasgo asintomático de talasemia beta que solo tiene consecuencias reproductivas, hasta el fenotipo grave dependiente de transfusiones de talasemia beta mayor. La eliminación clonalmente restringida adquirida del grupo de genes de la globina alfa o la mutación de ATRX está bien descrita en MDS.
La electroforesis de hemoglobina puede ayudar a distinguir anomalías subyacentes en la síntesis de globina; los resultados normales incluyen ~98 % de HbA, 1 a 2 % de HbA2 y <1 % de HbF. Los pacientes con betatalasemia tienen diferentes fenotipos de electroforesis dependiendo del número y tipo de alteraciones. El rasgo de talasemia beta tiene 92–95 % de HbA, >3,8 % de HbA2 y 1–4 % de HbF.
Los pacientes con talasemia beta intermedia tienen una síntesis de globina beta residual variable con HbA de 10 a 30 %, HbA2 de 2 a 5 % y HbF de 70 a 90 %. La betatalasemia mayor no produce síntesis de beta globina y muestra 0% de HbA, >95% de HbF y 2 a 5% de HbA2. Nuestro paciente tenía 94,5 % de HbA, 2,4 % de HbA2 y 3,1 % de HbF, lo más consistente con el rasgo de beta talasemia adquirida.
El MDS se asocia comúnmente con eritropoyesis ineficaz y anemia normocítica o macrocítica; los índices de glóbulos rojos microcíticos deben impulsar la evaluación de otra causa contribuyente, como la deficiencia de hierro, la talasemia adquirida, la deficiencia de cobre o la inflamación grave.
Las ganancias y pérdidas en el material genético son características de MDS, incluidas las anomalías recurrentes del cromosoma 11. La trisomía 11 se observa en el 1,5 % de los casos y las deleciones en 11q en otro 1 %, mientras que, en un estudio de 1084 pacientes con SMD, la haploinsuficiencia del cromosoma 11 o las deleciones de 11p estaban presentes en el 2 %, incluida la del(11p) en 6 pacientes , suma(11p) en 2 y der(11) en 5; todos estos pacientes tenían cariotipos complejos.6 Por lo tanto, la talasemia beta puede ser más común de lo descrito. Estos hallazgos subrayan el espectro de alteraciones fenotípicas que pueden ocurrir en MDS y otras neoplasias malignas hematológicas y resaltan otro mecanismo de hematopoyesis ineficaz que puede contribuir a la anemia asociada con MDS.