Los resultados de las encuestas fueron contundentes: aunque muchos pacientes comprendían que los medicamentos TIRF tienen una contraindicación absoluta. Es decir, no pueden ser utilizados por personas no tolerantes a los opioides
Agencia Latina de Noticias Medicina y Salud Pública
Los resultados de una investigación publicada recientemente, cuestionan seriamente la supervisión de la FDA, ya que un grupo de investigadores de la Escuela de Salud Pública Bloomberg de la Universidad Johns Hopkins afirma que los especialistas integrantes de la organización en realidad no tomó las suficientes precauciones, ni analizó correctamente los resultados obtenidos cuando obtuvieron pruebas de que productos de fentanilo, autorizados y aprobados por la FDA para uso en pacientes, estaban siendo recetados de manera inadecuada y en dosis potencialmente letales.
La investigación se publicó hace pocos días en el Journal of the American Medical Association, tras un exhaustivo análisis de 4.877 de páginas en informes realizados por la FDA, además de otros documentos adicionales a los que tuvieron acceso gracias a la Ley de Libertad de Información (FOIA, por sus siglas en inglés) de los años 2012 a 2017. Debido a que los documentos hacían parte de un programa de monitorización de la FDA, no son accesibles para el público o investigadores en general.
En el análisis de los informes, los investigadores notaron que la FDA y los fabricantes de medicamentos con fentanilo, no detallaron la información proporcionada, ni compararon los registros de prescripción cuando surgieron evidencias que -aparentemente- demostraban que la mitad de pacientes a los que se les recetó fentanilo, en la modalidad de fármacos TIRF, en realidad toman medicinas que pueden ser mortales o que causan graves efectos secundarios en los pacientes. Por otro lado, tampoco se detallaron los registros de prescripciones erróneas, recetadas por un único médico para considerar descalificarlos del programa.
Tanto la FDA como los fabricantes de fentanilo no diseñaron ni implementaron un programa de monitoreo efectivo", afirma el autor principal del estudio G. Caleb Alexander, profesor de Epidemiología y Medicina y codirector del Centro para la Seguridad y Eficacia de los Medicamentos en la Facultad Bloomberg al sitio web infosalus.com.
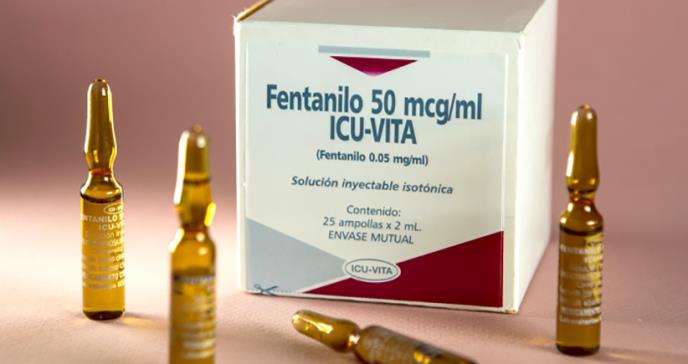
La polémica del estudio se suscita cuando Estados Unidos se encuentra sumida en una crisis de opioides, ya que los fentanilos TIRF -fentanilos de liberación inmediata transmucosos- son una amenaza para la salud pública por su veloz inicio de acción, alta potencia pues ingresan en segundos al torrente sanguíneo. Como consecuencia de este factor, este tipo de fármacos fueron aprobados por la FDA para pacientes afectados con cáncer "que ya están recibiendo y que son tolerantes a la terapia con opioides para su dolor de cáncer persistente subyacente".
Como se explica a infosalus.com, en el año 2011 la FDA estableció un programa de mitigación y evaluación de riesgos (REMS) que obligaba a los médicos, farmaceutas y pacientes a demostrar su conocimiento sobre el uso adecuado de los medicamentos TIRF y los riesgos a los que quedaban expuestos tras la prescripción y consumo. Este programa era desconocido para el público ya que fue concebido como un "sistema de distribución cerrado", el más estricto que maneja la FDA.
En adición a eso, en este programa la FDA exigió a los fabricantes de medicamentos TIRF que enviaran informes anuales a la organización para demostrar el cumplimiento de las exigencias. Para hacer estos reportes anuales, los fabricantes entrevistaron a médicos y pacientes con la intención de demostrar si se hacían prescripciones inseguras o fallidas.
Los resultados de las encuestas fueron contundentes: aunque muchos pacientes comprendían que los medicamentos TIRF tienen una contraindicación absoluta. Es decir, no pueden ser utilizados por personas no tolerantes a los opioides, en la encuesta de 2014 se demostró que el 39,4 de prescriptores de fármacos, lo utilizaban como medicina para tratar dolores crónicos en pacientes que no sufrían de cáncer. Cifras similares se registraron en años posteriores.
Sin embargo, la FDA solamente tomó medidas y replanteó las condiciones de su programa de prevención de riesgos cuando recibieron múltiples quejas y reclamaciones, aproximadamente 4 años después de la aparición del mencionado programa. Según los datos entregados por esas reclamaciones, más del 51% de pacientes tratados con TIRF eran personas con intolerancia a los opioides.
La FDA, en su propia evaluación de quinto año del programa TIRF REMS, a través de un comunicado reconoció que "no está cumpliendo con su objetivo general o con la mayoría de los objetivos". "La FDA y los fabricantes de TIRF confiaban demasiado en las encuestas y no crearon un programa desde el principio para evitar el uso inapropiado de TIRF. También perdieron oportunidades importantes para hacer revisiones sustanciales al programa, incluso cuando sonaban las alarmas", concluyó el investigador.
https://medicinaysaludpublica.com/crisis-de-opioides-supera-en-cifras-a-la-epidemia-del-vih/