Científicos del Instituto de Ciencias Fotónicas y la empresa B. Braun emplean una combinación de luz y nanopartículas de oro para prevenir la contaminación.

PUBLICADO EN 'NANO LETTERS'

Estas son las mallas quirúrgicas. Las de la pila de color cobrizo de la izquierda están recubiertas de nanopartículas de oro, y las blancas de la derecha son las originales antes del tratamiento de nanopartículas. Foto: ICFO
Científicos del Instituto de Ciencias Fotónicas y la empresa B. Braun emplean una combinación de luz y nanopartículas de oro para prevenir la contaminación.
Inventadas hace aproximadamente 50 años, las mallas quirúrgicas se han convertido en elementos clave para la recuperación de cirugías de tejidos dañados, siendo la reparación de la hernia la más común. Cuando se implantan en el tejido del paciente, su diseño flexible y adaptable ayuda a mantener los músculos tensos y permite que los pacientes se recuperen mucho más rápido que a través de la cirugía convencional.
Sin embargo, el implante de este tipo de mallas en el cuerpo de un paciente conlleva un riesgo de contaminación bacteriana durante la cirugía y la posterior formación de un biofilm infeccioso sobre la superficie de la malla quirúrgica. Estos biofilms tienden a actuar como un recubrimiento de plástico, impidiendo que cualquier tipo de agente antibiótico alcance y ataque las bacterias formadas en el biofilm para detener la infección.
Por lo tanto, las terapias con antibióticos, que son limitadas en el tiempo, podrían fallar contra estas bacterias resistentes y el paciente podría terminar en cirugías recurrentes o interminables que podrían incluso conllevar la muerte. De hecho, según la Red Europea de Vigilancia de la Resistencia a los Antimicrobianos (EARS-Net), en 2015 más de 30.000 muertes en Europa se vincularon a infecciones con bacterias resistentes a los antibióticos.
En el pasado, se han buscado varios métodos para prevenir la contaminación de los implantes durante la cirugía. A pesar de que se han implementado protocolos asépticos postquirúrgicos para combatir estas bacterias resistentes a los antibióticos, ninguno ha logrado resolver del todo este problema.
Ahora, en un estudio publicado en Nano Letters y destacado en Nature Photonics, los investigadores del ICFO Ignacio de Miguel y Arantxa Albornoz, dirigidos por el profesor ICREA Romain Quidant, en colaboración con los investigadores Irene Prieto, Vanesa Sanz, Christine Weis y Pau Turon de la compañía de dispositivos médicos y farmacéuticos B. Braun, han ideado una técnica novedosa que utiliza la nanotecnología y la fotónica para mejorar drásticamente el rendimiento de las mallas médicas en los implantes quirúrgicos.
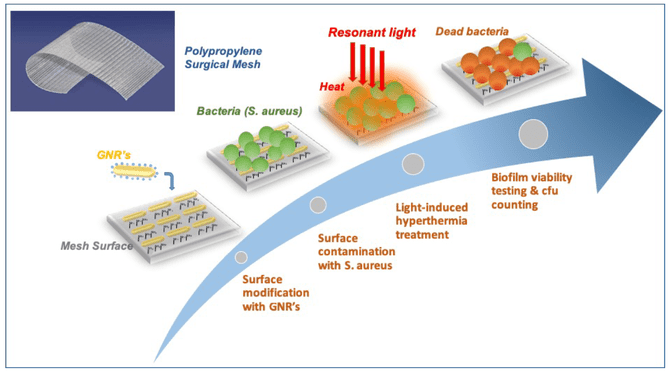
A través de una colaboración en curso desde 2012, el equipo ha desarrollado una malla médica con una característica particular: la superficie de la malla está modificada químicamente para anclar millones de nanopartículas de oro. ¿Por qué? Porque se ha demostrado que las nanopartículas de oro convierten de manera muy eficiente la luz en calor en regiones muy localizadas.
Esquema de cómo se consigue prevenir la formación de biofilms en mallas quirúrgicas. Foto: ICFO
La técnica del uso de nanopartículas de oro en procesos de conversión de luz-calor ya se había probado en estudios anteriores en tratamientos contra el cáncer. Concretamente, en el ICFO esta técnica se había implementado en varios estudios previos respaldados por la Fundación Cellex, siendo otro ejemplo sobresaliente de cómo el apoyo filantrópico visionario que pretende abordar problemas fundamentales puede terminar dando lugar a importantes aplicaciones prácticas.
En este caso en particular, teniendo en cuenta que más de 20 millones de operaciones de reparación de hernias se realizan cada año en todo el mundo, se creyó que este método podía reducir los costes médicos en las operaciones recurrentes y al mismo tiempo eliminar los costosos e ineficaces tratamientos con antibióticos que actualmente se emplean para combatir este problema.
Por lo tanto, en su experimento in vitro y mediante un exhaustivo proceso, el equipo cubrió la malla quirúrgica con millones de nanopartículas de oro, extendiéndolas uniformemente sobre toda la estructura. Probaron las mallas para garantizar la estabilidad de las partículas a largo plazo, la no degradación del material y el no desprendimiento o liberación de nanopartículas en el entorno circundante (matraz). Observaron una distribución homogénea de las nanopartículas sobre la estructura utilizando un microscopio electrónico de barrido (SEM).
Una vez lista la malla modificada, el equipo la expuso a la bacteria S. aureus durante 24 horas hasta que observó la formación de un biofilm en la superficie. Posteriormente, expusieron la malla a pulsos cortos e intensos de luz infrarroja cercana (800 nm) durante 30 segundos para asegurar que se alcanzara el equilibrio térmico y repitieron el procedimiento 20 veces con un intervalo de cuatro segundos de descanso entre cada pulso.
Descubrieron lo siguiente: en primer lugar, vieron que iluminar la malla con una frecuencia específica inducía resonancias plasmónicas de superficie localizadas en las nanopartículas, lo cual resulta en la conversión eficiente de luz en calor, quemando así las bacterias sobre la superficie. En segundo lugar, usando un microscopio confocal de fluorescencia, vieron cuantas bacterias habían muerto y cuantas estaban aún vivas.
Respecto a las bacterias que habían sobrevivido, observaron que las del biofilm se convirtieron en células planctónicas, recuperando su sensibilidad a la terapia con antibióticos y a la respuesta del sistema inmunológico. En cuanto a las bacterias muertas, observaron que al aumentar la cantidad de luz que llega a la superficie de la malla, las bacterias perdían su adherencia y se desprendían de la superficie.
En tercer lugar, confirmaron que operar en rangos de luz infrarroja cercana era perfectamente compatible con condiciones in vivo, por lo que es probable que esta técnica no dañase el tejido sano circundante. Finalmente, repitieron el tratamiento y confirmaron que el calentamiento recurrente de la malla no había afectado a su eficiencia de conversión de luz a calor.
Tal y como comenta el profesor Quidant, “los resultados de este estudio han allanado el camino hacia el uso de nanotecnología plasmónica para prevenir la formación de biofilms bacterianos en la superficie de los implantes quirúrgicos. Todavía hay varias cuestiones que deben abordarse, pero es importante enfatizar que dicha técnica significará un cambio radical en los procedimientos quirúrgicos y la posterior recuperación del paciente”.
Como director de Investigación y Desarrollo de B. Braun Surgical, Pau Turon explica: “Nuestro compromiso con los profesionales de la salud para ayudarles a evitar infecciones hospitalarias nos empuja a desarrollar nuevas estrategias para combatir las bacterias y los biofilms. Además, el equipo de investigación está explorando las posibilidades de extender dicha tecnología a otros sectores en los cuales los biofilms deberían ser evitados”.
NanoLetters (2019), doi: 10.1021/acs.nanolett.9b00187