Por: Henry González, MD
Bárbara Rosado Carrión, MD, FAGA, FACP
Federico Rodríguez Pérez, MD, FAGA
Palabras claveshepatitis C, interferón, respuesta viral sostenida, agentes de acción directa
Keywordshepatitis C, inteferon, sustained virological response, direct acting agents
La hepatitis C es la causa principal de trasplante de hígado en Puerto Rico y los Estados Unidos. La enfermedad se caracteriza por cronicidad y daño hepático progresivo. La terapia contra la hepatitis C ha evolucionado desde la época del interferón hasta el presente en la cual surgen los Agentes de Acción Directa. Con estos nuevos fármacos la probabilidad de cura de los pacientes con hepatitis C ha progresado de un veinte hasta un cien por ciento con muchas de las combinaciones disponibles. Los nuevos fármacos se caracterizan por un perfil de seguridad excelente además de su efectividad. Varias asociaciones médicas tanto de hepatología como de infectología han establecido guías para la administración de estos medicamentos según el genotipo del paciente y las características clínicas del paciente: cirrosis descompensada, disfunción renal y recurrencia de la hepatitis C luego de trasplante hepático.
Hepatitis C is the principal cause of liver transplant in Puerto Rico and in the United States. Hepatitis C is characterized by progressive liver damage. The therapy of hepatitis C has evolved from the era of interferon to the era of direct acting agents. With the new treatments the probability of cure for patients with Hepatitis C has evolved from twenty to one hundred percent with several of the available combinations. These new therapies have an excellent safety profile and cure rate. Several hepatology and infectious diseases associations have established guidelines for the treatment of hepatitis C in patients with decompensated cirrhosis, renal dysfunction and patients with HCV recurrence after liver transplantation.
“La biopsia hepática es más precisa para establecer el grado histológico, sin embargo es invasiva y presenta riesgo de sangrado especialmente en pacientes con coagulopatías o cirrosis. El Fibroscan es una técnica aprobaba recientemente por el FDA no invasiva y altamente confiable”
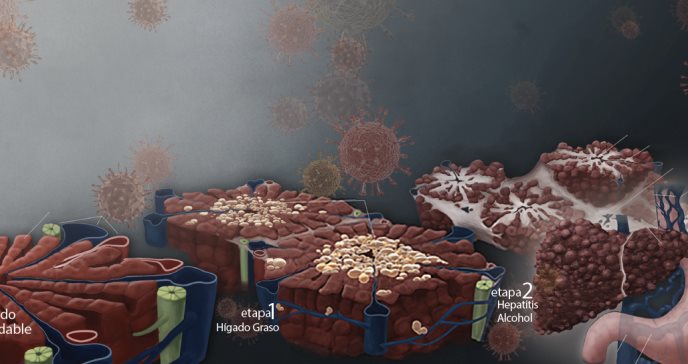
La hepatitis C (VHC) es una enfermedad viral que se caracteriza por causar inflamación y daño al tejido hepático. Hasta un 20% de los pacientes terminan con cirrosis y complicaciones clínicas asociadas a la hipertensión portal como retención de líquido, ascitis, encefalopatía y sangrado de várices. Los pacientes con cirrosis también están a mayor riesgo de desarrollar cáncer del hígado1. Estas complicaciones hacen de la hepatitis C la causa principal de trasplante hepático en Puerto Rico y en los Estados Unidos.
Cerca de 170 millones de personas alrededor del mundo tienen VHC2. En Puerto Rico la prevalencia de la hepatitis C es más alta (2.3% de la población) que en los Estados Unidos donde la prevalencia es de 1.8%3. Estudios epidemiológicos demuestran que la prevalencia de esta enfermedad en Puerto Rico es también mayor que en Latino América, incluyendo países como Colombia, Méjico y Brasil4.
Existen 6 genotipos de la hepatitis C. El genotipo 1 es el más común en Puerto Rico, los Estados Unidos y Latino América. El 85% de los pacientes en Puerto Rico están infectados con el genotipo 1 y un 10% con genotipo 2. Los genotipos 3,4,5 y 6 son menos frecuentes5. Desafortunadamente, hasta un 50% de las personas infectadas desconocen su diagnóstico y solamente un 5% de aquellos diagnosticados reciben tratamiento adecuado para esta condición6.
El grado de daño histológico del paciente debe ser evaluado al momento del diagnóstico y antes de comenzar tratamiento ya que esta información ayuda a determinar la duración de la terapia. Además, el estadío histológico sirve como herramienta para establecer la prognosis del paciente. Existen varias maneras de establecer el grado de fibrosis de un paciente: biopsia de hígado percutánea, marcadores serológicos como el FibroTest y la elastografía hepática (Fibroscan). Aunque la biopsia hepática es la forma más precisa de establecer el grado histológico, la misma es invasiva y presenta riesgo de sangrado especialmente en pacientes con coagulopatías o cirrosis. El Fibroscan es una técnica aprobaba recientemente por el FDA (Food and Drug Administration) no invasiva y altamente confiable para descartar o establecer la presencia de cirrosis7. El método es confiable, reproducible y solamente toma minutos en hacer.
Una vez se obtiene la información sobre el estadío de fibrosis se puede tomar una decisión más efectiva sobre el tratamiento. Se recomienda tratar los pacientes con viremia detectable (HCV RNA positivo) y que estén dispuestos a seguir un régimen terapéutico según recetado. Las guías de la sociedad americana de hepatología (AASLD) recomiendan dar prioridad de tratamiento a pacientes con fibrosis avanzada (F3-F4), ya que estos pacientes están a un riesgo mayor de desarrollar complicaciones que resulten en un trasplante hepático o en la muerte8. Los pacientes cirróticos que reciban tratamiento deben ser pacientes compensados (sin ascitis, encefalopatía o sangrado por várices) o poblaciones selectas de pacientes descompensados pero estos deben recibir el tratamiento en un centro de trasplante o dentro del marco de un protocolo diseñado para este tipo de paciente. Sin embargo, todo paciente con hepatitis C que quiera ser tratado debe recibir tratamiento.
El propósito de este artículo es tratar de resumir el desarrollo de la terapia de la hepatitis C desde la época del interferón hasta el presente utilizando las guías publicadas por el AASLD como marco de referencia. Se han incluido los adelantos alcanzados en pacientes coinfectados con el virus de inmunodeficiencia humana (VIH) ya que son paralelos a los pacientes mono-infectados y han logrado aumentar la expectativa de vida de estos pacientes.
El tratamiento de la Hepatitis C ha cambiado de una terapia plagada de efectos secundarios a una altamente efectiva y muy bien tolerada. Inicialmente se administraba interferón subcutáneo tres veces por semana por un período de seis meses a un año dependiendo del genotipo del paciente. La respuesta viral sostenida (HCV RNA no detectable luego de seis meses de terminar la terapia) no sobrepasaba el 20%9. Eventualmente surge la combinación del interferón con ribavirina y aumenta la respuesta viral sostenida (RVS) a un 30%. Desafortunadamente, la ribavirina está asociada con hemólisis y anemia por lo cual pacientes con historial cardíaco no toleran bien este medicamento. Además, la ribavirina es teratogénica y los pacientes tienen que utilizar métodos contraceptivos para evitar el embarazo. Finalmente, la época del interferón culmina con el interferón peguilado el cual se administra solamente una vez por semana y mantiene los niveles de interferón elevados entre cada dosis. Con esta combinación se aumentó la RVS a cerca del 43%10.
El panorama de los pacientes con VHC empieza a cambiar con la llegada de los inhibidores de proteasa de primera generación, boceprevir y telaprevir11,12. Estos dos medicamentos son los primeros en la categoría de los agentes de acción directa (AAD). Se interrumpe de una manera más efectiva la replicación del VHC. El boceprevir y el telaprevir se utilizaban exclusivamente en pacientes infectados con genotipo 1 y se administraban con interferón peguilado y ribavirina. Aunque con estos dos medicamentos la RVS aumentó a un 60%, la terapia estaba plagada de efectos secundarios severos. Los pacientes cirróticos, especialmente aquellos con plaquetas y albuminas bajas, tenían hasta un 30% de probabilidad de desarrollar efectos adversos serios, incluyendo sepsis y deterioro hepático. Además, la administración de estos medicamente seguía un esquema difícil de implementar que incluía la toma de múltiples muestras de la carga viral del VHC.
Finalmente, aparecen en el arma-mentario terapéutico de estos pacientes los agentes de acción directa (AAD), llamados así porque inhiben los proteínas que el virus utiliza para su replicación: NS4B y NS5A, la polimerasa NS5B y el complejo NS3-NS4A13. La ventaja de estos medicamentos es que los factores clínicos que afectaban la RVS en pacientes que recibían las terapias con interferón dejan de ser determinantes.
La asociación americana para el estudio del hígado (AASLD) ha sugerido unas guías de tratamiento en conjunto con la asociación de infectología (IDSA) de acuerdo al genotipo del paciente. El resumen de las terapias nuevas para la hepatitis C en poblaciones difíciles de tratar (cirrosis descompensada, disfunción renal y recurrencia luego de trasplante) va a ser discutido utilizando como base las últimas guías publicadas por estas sociedades médicas14.
Los pacientes con cirrosis des-compensada son aquellos que han desarrollado complicaciones clínicas debido al deterioro de su función hepática. Las complicaciones principales son el desarrollo de ascitis, encefalopatía hepática, sangrado variceal e ictericia. Algunas maneras de cuantificar el grado de severidad de los pacientes son el criterio Child Turcotte Pugh (CTP) y la escala MELD. El sistema de puntuación MELD utiliza los valores séricos de bilirrubina, creatinina y el INR para predecir la supervivencia de los pacientes. El criterio CTP de severidad de enfermedad hepática se realiza de acuerdo al grado de ascitis, las concentraciones plasmáticas de bilirrubina y albumina, el tiempo de protrombina y el grado de encefalopatía. Pacientes bien compensados reciben una clasificación grado A, mientras que aquellos con complicaciones serias reciben una clasificación B y C. Hasta ahora, los pacientes con cirrosis descompensada han sido difíciles de tratar debido al hecho de que el interferón, los inhibidores de proteasa de primera generación y la ribavirina estaban asociados a efectos adversos severos incluyendo sepsis y muerte. Sin embargo, las últimas guías de tratamiento del AASLD incluyen recomendaciones para pacientes clasificados B ó C por la escala CTP.
Los pacientes genotipo 1 y 4 con cirrosis descompensada deben ser referidos a centros especializados en el tratamiento de este tipo de paciente y donde haya opción de trasplante hepático. La respuesta viral sostenida en estos pacientes es parecida a la obtenida en pacientes con cirrosis compensada y el uso de ribavirina fue bien tolerado. La mayoría de los pacientes que recibieron dosis de ribavirina de 600 mg no requirieron dosis más elevadas y esto no tuvo efecto adverso en las respuesta final.
Para pacientes con genotipo 1 ó 4 con clasificación CTP B ó C que puedan ser o no candidatos a trasplante de hígado, incluyendo los pacientes con carcinoma hepatocelular se recomiendan las siguientes terapias:
En pacientes que no toleren el uso de la ribavirina se recomiendan las siguientes terapias:
Aquellos pacientes genotipo 1 ó 4 que sean CTP B ó C y que hayan fallado terapias previas con sofosbuvir pueden utilizar una dosis diaria de ledipasvir (90 mg)/sofosbuvir (400 mg) con una dosis inicial de ribavirina de 600 mg (aumentada según tolerada) por 24 semanas18.
Pacientes genotipo 2 y 3 que sean CTP B ó C incluyendo los candidatos a trasplante hepático, incluyendo aquellos con carcinoma hepatocelular se pueden beneficiar del uso de diario de daclastavir (60 mg) con sofosbuvir (400 mg) con una dosis inicial baja de ribavirina de 600 mg (aumentada según tolerada) por 12 semanas19,20.
La Hepatitis C puede ser una causa y una complicación de enfermedad crónica renal. Infección crónica con el virus de Hepatitis C puede llevar a síndromes de complejos inmunes como cryoglobulinemia y glomerulonefritis membranoproliferativa. También complica a los pacientes de fallo renal terminal y trasplante renal. La fuente de infección se cree que es nosocomial. La infección se asocia con empeoramiento de la sobrevida en pacientes de diálisis y trasplante renal. El tratamiento de la hepatitis C en estos pacientes solía ser problemática y poco efectiva hasta el advenimiento de los agentes de acción directa (DAA).
El estudio C-SURFER evaluó la seguridad y eficacia del inhibidor de proteasa de segunda generación NS3/NS4A grazoprevir (100 mg una vez al día) y un inhibidor de NS5A elbasvir (50 mg una vez al día) por 12 semanas en pacientes genotipo 1 con enfermedad crónica de riñón estadios 4/5. Los participantes fueron pacientes genotipo 1 con enfermedad crónica de riñón estadios 4/5 , 75% en hemodiálisis, 45% afroamericanos. Un número pequeño de pacientes tenían cirrosis. La respuesta virológica sostenida fluctuó entre 94% a 99%. No hubo cambios en hemoglobina, efectos adversos distintos o uso de eritropoyetina comparados con el grupo placebo. Ninguno de los pacientes genotipo 1a con la variante asociada a resistencia NS5A (NS5A RAVs ) desarrolló relapso viral. Solo hubo un relapso en un paciente genotipo 1b. Basado en esta data , la combinación fija de elbasvir (50 mg ) y grazoprevir (100 mg) se recomienda para el tratamiento de pacientes genotipo 1 con función renal severamente comprometida. No se recomienda el evaluar para NS5A RAVs en esta población21.
Sofosbuvir y ribavirina se eliminan renalmente. La seguridad y dosis efectiva de Sofosbuvir en pacientes con depuración de creatinina de menos de 30 mL/min/1.73m2 no se ha establecido. A pesar de que hay recomendaciones para reducir la dosis y la frecuencia de ribavirina en pacientes con daño renal, esta droga es pobremente tolerada en esta población.
Daclatasvir, ledipasvir, simeprevir, elbasvir/grazoprevir se metabolizan primariamente por el hígado. Tienen una mínima excreción renal. Por tanto, no necesitan ajuste de dosis en pacientes renales.
El estudio HCV-TARGETes un estudio prospectivo observacional que evalúa el uso de los agentes antivirales de acción directa (DAA) en prácticas clínicas a través de Estados Unidos y Europa. El estudio reportó la seguridad y efectividad de regímenes que contienen sofosbuvir en pacientes con compromiso renal de leva a severo (eGFRs <30, 31-45, 46-60, y > 60 mL/min). Los pacientes recibieron diferentes regímenes que contenían sofosbuvir ( PEG-IFN, RBV y sofosbuvir, simeprevir y sofosbuvir con o sin RBV o sofosbuvir y RBV. Los regímenes fueron bien tolerados y no hubo descontinuaciones en los pacientes con funciones renales bajas. Las respuestas virales sostenidas fueron similares entre los grupos sin importar la función renal. Hubo un deterioro progresivo de la función renal en los pacientes con eGFR< 30 mL/min, lo que sugiere que hay que monitorear estos pacientes mas de cerca. Se puede concluir del estudio que los pacientes con compromiso en la función renal tienen una mayor frecuencia de anemia y deterioro renal pero la respuesta es similar comparada con los pacientes sin compromiso renal22.
Hay información de pacientes tratados con un régimen de simeprevir y sofosbuvir sin ribavirina con una respuesta virológica sostenida de 89 % 23.
Veinte pacientes con genotipo 1 sin cirrosis con estadio renal 4 ó 5 (eGFR<30 mL/min/1.73m2) fueron tratados con la combinación fija de paritaprevir (150 mg)/ ritonavir (100 mg)/ombitasvir (25 mg)/dasabuvir (250 mg dos veces al día) con o sin ribavirina. La mayoría de los pacientes, con o sin cirrosis, tratados con o sin ribavirina alcanzaron respuesta virológica sostenida. Debido a que la anemia inducida por ribavirina ocurrió frecuentemente, es requerido un monitoreo cercano de los pacientes y reducciones juiciosas de ribavirina24.
Recurrencia de la infección del virus de la hepatitis C luego del trasplante hepáticoLa recurrencia de la infección del virus de la hepatitis C ocurre universalmente en el órgano trasplantado en aquellos pacientes con viremia al momento del trasplante. El 75% de los pacientes trasplantados con la infección desarrollaran histológicamente hepatitis, seis meses después del trasplante.25 De no tratarse la infección, el 30% de los pacientes desarrollaran cirrosis hepática durante los primeros 5 años después del trasplante.26 Hay una proporción pequeña de pacientes (4-7%) que presentara una forma más severa de la infección (hepatitis C colestatica) con progresión rápida a fallo hepático. La sobrevida de pacientes trasplantados infectados con el virus de la hepatitis C es menor cuando se compara con otras indicaciones para trasplante de hígado.27 El tratamiento de la infección es altamente recomendada en la población de pacientes trasplantados para evitar la progresión a cirrosis y la pérdida del órgano trasplantado.28 En el pasado las terapias disponibles estaban plagadas de toxicidad con una pobre tolerabilidad y una tasa baja de cura virológica. A continuación discutiremos las nuevas indicaciones de tratamiento de agentes de acción directa para esta población tan particular, recientemente aprobadas por la FDA.
Pacientes infectados con el Genotipo 1 o 4 (nunca tratados y previamente tratados) incluyendo pacientes con cirrosis compensada:Ledispavir 90 mg/sofosbuvir 400mg – una tableta diaria por 12 semanas en combinación con Ribavirina (dosificada por peso del paciente). En pacientes que no pueden tolerar o son inelegibles al uso de RBV el tratamiento deberá extenderse a 24 semanas.
Daclastasvir (60mg) en combinación con Sofosbuvir (400mg) diariamente con dosis bajas de RBV de 600mg (aumentada según se tolere) por 12 semanas. En pacientes que no puedan tolerar o sean inelegibles al uso de RBV, la duración el tratamiento deberá extenderse a 24 semanas. Este mismo régimen también ha sido aprobado para pacientes infectados con el genotipo 3 en la población de pacientes post- trasplantados.
Pacientes infectados con el Genotipo 1 o 4 (nunca tratados y previamente tratados) incluyendo pacientes con cirrosis descompensada, Child clase B o C:Ledispavir 90 mg/sofosbuvir 400mg (Harvoni) – una tableta diaria por 12 semanas en combinación con Ribavirina a dosis inicial baja de 600 mg ( a ser aumentada según tolerada).
Régimen alterno para pacientes con fibrosis temprana (Metavir 0-2) infectados con el genotipo 1.Paritaprevir/ritonavir/ombitasvir con dasabuvir dos veces al día en combinación con RBV por 24 semanas se pudiera considerar como terapia alterna en pacientes con poca fibrosis en el órgano trasplantado. Es importante monitorear los niveles de tacrolimus y ciclosporina ( drogas anti-rechazo) ya que los niveles pueden aumentar significativamente por lo que se requiere ajustes en la terapia.
Pacientes infectados con el Genotipo 2 o 3 (nunca tratados y previamente tratados) incluyendo pacientes con cirrosis compensada:Daclastasvir (60mg) en combinación con Sofosbuvir (400mg) diariamente con dosis iniciales bajas de RBV de 600mg (aumentada según se tolere) por 12 semanas. En pacientes que no puedan tolerar o sean inelegibles al uso de RBV, la duración el tratamiento deberá extenderse a 24 semanas
Terapia alterna seria Sofosbuvir 400 mg diario en combinación con RBV (ajustada por peso) por 24 semanas.
Los estudios clínicos que resultaron en la aprobación de estas terapias en la población de trasplantados demostraron un porciento alto de cura virológica (Respuesta virológica sostenida= RVS). En el estudio de fase 3 (ALLY-1) se demostró una RVS de 94%, utilizando la combinación de Daclastavir y Sofosbuvir, más RBV por 12 semanas.29 La terapia fue bien tolerada y no hubo interacciones clínicamente significativas con las drogas anti-rechazo utilizados por los pacientes trasplantados incluyendo los inhibidores de calcineurin. El estudio clínico SOLAR-1 y SOLAR-2 estudiaron la combinación de Ledipasvir/sofosbuvir más RBV ajustada por peso por una duración de 12 o 24 semanas alcanzando una RVS de aproximadamente 96% en ambos grupos.30 Tampoco hubo interacciones significativas o ajustes necesarios con las drogas anti-rechazo cuando se combina con esta terapia.
El advenimiento de drogas de acción directa para el tratamiento de la infección del virus de la hepatitis C ha beneficiado e incluido a poblaciones especiales como los pacientes con enfermedad hepática descompensada, pacientes renales y pacientes trasplantados con recurrencia del virus, los cuales en el pasado estaban limitados de terapias por la escasez de data y la falta de inclusión de estos grupos en estudios clínicos. Afortunadamente, en la actualidad estas poblaciones gozan de opciones farmacológicas con una alta posibilidad de cura.