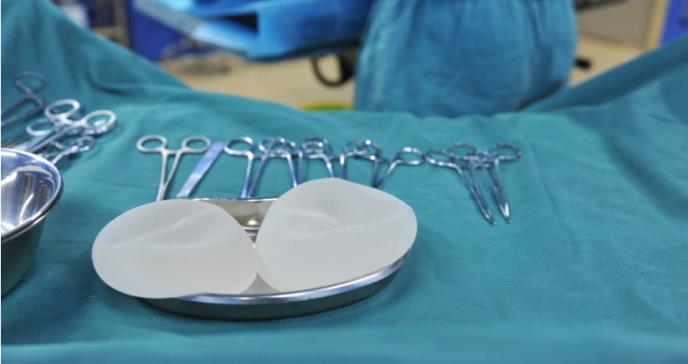
En la información también se menciona que entre la cirugía de implantación y la obtención del diagnóstico transcurrió un lapso de 7 años. La edad de las mujeres afectadas se encuentra entre los 25 y 91 años.
Agencia Latina de Noticias Medicina y Salud Pública
| Este artículo contiene extractos de la declaración de Binita Ashar, M.D., del Centro de Dispositivos y Salud Radiológica de la FDA sobre los esfuerzos continuos de la agencia para educar a los pacientes sobre el riesgo conocido de linfoma producido por implantes mamarios. La declaración fue publicada originalmente en inglés en el sitio web de la FDA. |
Por ejemplo, nuestro análisis de estos informes es mejor cuando existe una amplia gama de información sobre la textura del implante mamario y el relleno del implante, y otros detalles útiles como la edad de la paciente, el tiempo que ha estado implantada y el tiempo transcurrido desde la implantación hasta el diagnóstico. Esta información nos ayuda a entender cómo y por qué puede estar ocurriendo este linfoma", se explica en el documento.Según la FDA, desde el año pasado se evidencia un incremento en 246 nuevos MDRs (informes de dispositivos médicos) desde el año pasado. Y aunque este tipo de eventos son esperables, la FDA también afirma que esto contribuye a la comprensión y representa un análisis más completo y exhaustivo. Sin embargo, el informe se presentó porque el tipo de linfoma reportado no es común pero sí bastante agresivo, lo que complica su detección y diagnóstico adecuado. El linfoma anaplástico de células grandes es una condición que afecta a los ganglios linfáticos y áreas extraganglionares. De acuerdo con el comunicado de prensa, en las pacientes con implantes mamarios, la enfermedad se produce en el tejido cicatricial del seno. En la información también se menciona que entre la cirugía de implantación y la obtención del diagnóstico transcurrió un lapso de 7 años. La edad de las mujeres afectadas se encuentra entre los 25 y 91 años.