Un nuevo diseño, creado en el Hospital Infantil de Boston podría permitir a los niños mantener la misma válvula cardíaca protésica hasta la edad adulta.

Servicios Combinados MSP
Las actuales válvulas cardíacas que se implantan en los niños con cardiopatías congénitas presenten un grave problema: son de un tamaño único y, por eso, a medida que el niño va creciendo, se hace necesario su reemplazo, lo que se traduce en nuevas intervenciones quirúrgicas, con las molestias y riesgos que eso supone. Pero ahora, es posible que esta situación cambie totalmente.
Un nuevo y sorprendente diseño, creado en el Hospital Infantil de Boston (EE.UU.) podría permitir a los niños mantener la misma válvula protésica hasta la edad adulta y, también, podría beneficiar a los adultos cuyas válvulas cardíacas está defectuosas. El nuevo dispositivo se describe en Science Translational Medicine.
Tanto las pruebas llevadas a cabo en el laboratorio, las simulaciones informáticas y los test llevados a cabo en modelos animales grandes demuestran que el nuevo diseño funciona en una amplia gama de tamaños y que la válvula conserva su funcionalidad cuando se expande mediante un procedimiento de catéter con balón mínimamente invasivo.
"Esperamos iniciar los análisis en humanos en breve", asegura Pedro J. del Nido, del Hospital Infantil de Boston, autor principal del artículo y una de las eminencias en la cirugía cardíaca infantil. "Si nuestros resultados preclínicos se mantienen en humanos, esto podría transformar este campo médico".
Más de 330.000 niños en todo el mundo nacen con un defecto de la válvula cardíaca, y millones desarrollan enfermedades cardíacas que requieren un reemplazo temprano de la válvula. Las válvulas cardíacas protésicas actuales tienen un diámetro fijo, por lo que generalmente deben reemplazarse cada pocos años; los niños que reciben su primer reemplazo antes de los 2 años necesitarán hasta cinco operaciones de corazón abierto de alto riesgo antes de llegar a la edad adulta.
Las válvulas cardíacas protésicas disponibles comercialmente tienen tres valvas, pequeñas aletas que proporcionan una entrada o salida unidireccional para que la sangre siga fluyendo en la dirección correcta. El nuevo diseño se inspiró en las válvulas venosas humanas, ubicadas en las venas profundas de la pierna.
A diferencia de las válvulas de flujo de salida nativas de nuestros corazones, nuestras válvulas venosas tienen solo dos valvas y una geometría que está optimizada para mantener el cierre y el flujo unidireccional, incluso cuando las venas se expanden en diámetro para acomodar grandes volúmenes de sangre que pasan.
"Las venas transportan aproximadamente el 70 por ciento de nuestro volumen de sangre", afirma Sophie C. Hofferberth, que dirigió la investigación en el laboratorio del Nido, a ABC. "Las dimensiones de las venas pueden cambiar drásticamente dependiendo de la posición del cuerpo, pero las válvulas deben permanecer funcionales. Imitamos el perfil geométrico de la válvula venosa humana para diseñar una válvula de dos vías de dimensiones programadas que se adapte al crecimiento sin pérdida de control de flujo unidireccional".
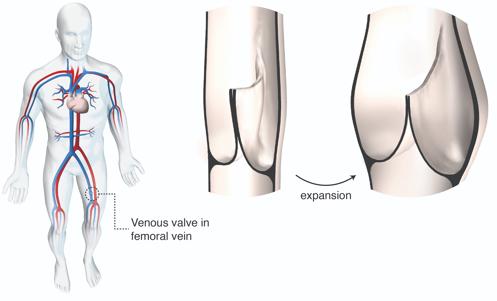
Foto: Sophie C. Hofferberth, Lara Tomholt.
En múltiples test, tanto en modelos de sobremesa como en animales grandes, los prototipos de válvula con el diseño biomimético de dos láminas pudieron expandirse para acomodar el crecimiento y las asimetrías estructurales dentro del corazón. Las válvulas permanecieron completamente funcionales en una amplia gama de dimensiones, en un rango de presión y de flujo.
Debido a que la válvula está diseñada para expandirse sin requerir que el marco y el folleto se estiren o agranden, es compatible con una gama de materiales disponibles en el mercado, aseguran los investigadores.
Además, el estudio mostró que el dispositivo podría expandirse efectivamente en múltiples etapas en un modelo animal en crecimiento, utilizando un enfoque de catéter con balón mínimamente invasivo.
Los investigadores también observaron que su diseño "geométricamente adaptable" alienta un perfil de flujo sanguíneo favorable a través de la válvula, reduciendo potencialmente el riesgo de formación de coágulos sanguíneos que a menudo se observa con los dispositivos de reemplazo valvular existentes. En el modelo de ovejas en crecimiento, no hubo evidencia de formación de coágulos sanguíneos durante 10 semanas de observación, incluso sin el uso de medicamentos anticoagulantes que se administran típicamente a los receptores de válvulas protésicas.
"Una deficiencia de muchos dispositivos existentes es la presencia de interrupciones del flujo que conducen a la formación de coágulos sanguíneos y al deterioro temprano de la válvula", apunta Hofferberth.
"Nuestro diseño logra un perfil de flujo favorable que parece facilitar el lavado efectivo de la válvula y minimizar el estancamiento del flujo, que probablemente sea un determinante importante de la durabilidad del dispositivo a largo plazo",
agregó.
Los expertos creen que sus datos respaldan el inicio de un estudio clínico dentro de uno o dos años.