Este estudio tiene como objetivo describir la frecuencia del fracaso de la terapia biológica en pacientes con psoriasis junto con la demografía y las características asociadas de los pacientes
ABSTRACT
Objective: This study aims to describe the frequency of biologic therapy failure in psoriasis patients along with associated patient demographics and characteristics.
Methods: This was a retrospective medical-record review of psoriasis patients evaluated from January 1st, 2013, through May 1st, 2018, and who failed at least once to adhere to their biologic therapy.
Results: Seventy-seven patients with psoriasis who had discontinued biologic therapy at least once were included in this study. Hypertension (58.4%), diabetes (37.7%), dyslipidemia (27.3%), and psoriatic arthritis (23.4%) were the main comorbidities observed. Adalimumab (ADA, 80.5%), ustekinumab (UST, 70.1%), and etanercept (ETA, 14.2%) were the most frequently used biologics in our cohort. The biologic with the longest mean duration of use prior to its discontinuation was UST (17.0 months), followed by ADA (15.9 months) and ETA (13.6 months).
Conclusion: The most common reason for discontinuing biologic therapy was that said therapy was not effective, though for ETA and UST, the fact that biologic therapies are not universally covered by insurance companies was found to be associated with their discontinuation, as well. There were no statistically significant associations found between biologic therapy discontinuation and age, gender, or comorbidities, which last included obesity, class I. Larger studies are warranted to identify risk factors associated with biologic therapy failure to help guide drug selection, decrease morbidity associated with such nonadherence and improve patient outcomes. [P R Health Sci J 2021;40:63-67]
RESUMEN
Objetivo: Este estudio tiene como objetivo describir la frecuencia del fracaso de la terapia biológica en pacientes con psoriasis junto con la demografía y las características asociadas de los pacientes.
Métodos: Esta fue una revisión retrospectiva de historias clínicas de pacientes con psoriasis evaluados desde el 1 de enero de 2013 hasta el 1 de mayo de 2018, y que no cumplieron al menos una vez con su terapia biológica.
Resultados: Se incluyeron en este estudio 77 pacientes con psoriasis que habían discontinuado la terapia biológica al menos una vez. La hipertensión arterial (58.4%), la diabetes (37.7%), la dislipidemia (27.3%) y la artritis psoriásica (23.4%) fueron las principales comorbilidades observadas. Adalimumab (ADA, 80.5%), ustekinumab (UST, 70.1%) y etanercept (ETA, 14.2%) fueron los biológicos más utilizados en nuestra cohorte. El biológico con mayor duración media de uso antes de su suspensión fue UST (17.0 meses), seguido de ADA (15.9 meses) y ETA (13.6 meses).
Conclusión: La razón más común para descontinuar la terapia biológica fue que dicha terapia no fue efectiva, aunque para ETA y UST, el hecho de que las terapias biológicas no estén universalmente cubiertas por las compañías de seguros, también se asoció con su descontinuación. No se encontraron asociaciones estadísticamente significativas entre la interrupción de la terapia biológica y la edad, el sexo o las comorbilidades, que por último incluyeron la obesidad, clase I. Se justifican estudios más amplios para identificar los factores de riesgo asociados con la falla de la terapia biológica para ayudar a guiar la selección de medicamentos, disminuir la morbilidad asociada con dicha falta de adherencia y mejorar los resultados de los pacientes. [PR Health Sci J 2021;40:63-67]
Se han hecho muchos avances con respecto a los medicamentos biológicos para el tratamiento de la psoriasis, aunque la interrupción de estos agentes (debido a la ineficacia, los efectos secundarios, el hecho de que las terapias biológicas no están universalmente cubiertas por las compañías de seguros y/o la preferencia de los pacientes) sigue siendo un problema. reportado (1, 2, 3, 4). Se ha informado que el cambio biológico, la interrupción de un biológico para la transición a otro, llega al 44.1 % (2).
La principal razón que dan los pacientes con psoriasis para suspender su terapia biológica es la ineficacia de dicho tratamiento (3, 5). En consecuencia, Gniadecki et confirmaron que la eficacia de un biológico disminuye con el tiempo (6). La supervivencia del fármaco, o el tiempo hasta la interrupción de un fármaco, está determinada por el perfil de eficacia y seguridad de un medicamento determinado, así como por otros factores (7). Se estima que la supervivencia promedio de un medicamento biológico es de 5 años (5, 8). El índice de masa corporal (IMC) (4), la inmunogenicidad biológica (9,10) y el consumo de alcohol y tabaco (11) se han asociado con la ineficacia del tratamiento y la interrupción posterior de la terapia biológica. Así mismo, algunos estudios han encontrado que el ser mujer predispone a dichas pacientes a desarrollar efectos secundarios que comprometen la supervivencia del fármaco (4). El objetivo de este estudio fue el identificar las características de los pacientes que podrían servir como predictores para la interrupción de la terapia biológica. Para mejorar los resultados del tratamiento y disminuir la morbilidad en pacientes con psoriasis, es importante detectar a aquellos que están en riesgo de fracaso de la terapia biológica.
PACIENTES Y MÉTODOS
Extracción de datos
Luego de su aprobación por la junta de revisión institucional de la Facultad de Medicina de la Universidad de Puerto Rico (protocolo n.º B1340218), se realizó una revisión retrospectiva del expediente médico electrónico (EMR) en las Clínicas de Dermatología de la Facultad de Medicina de la Universidad de Puerto Rico. Este estudio incluyó pacientes de 18 años o más con diagnóstico de psoriasis que habían fallado la terapia biológica al menos una vez y que habían sido evaluados desde el 1 de enero de 2013 hasta el 1 de mayo de 2018. Los datos recopilados incluyeron edad, sexo, IMC, comorbilidades, antecedentes sociales (incluyendo si el paciente consumió activamente alcohol o tabaco durante su tratamiento con un agente biológico), duración del tratamiento y los motivos de la interrupción de la terapia biológica (ineficacia, efectos secundarios, problemas de seguro u otros). Ciertas frases en los registros médicos indicaron una falta de eficacia correspondiente. Los médicos evaluadores generaron comentarios sobre las evaluaciones de EMR como “falta de mejoría” y “lesiones refractarias”, cuyos comentarios se consideraron relacionados con la terminación final de la terapia.
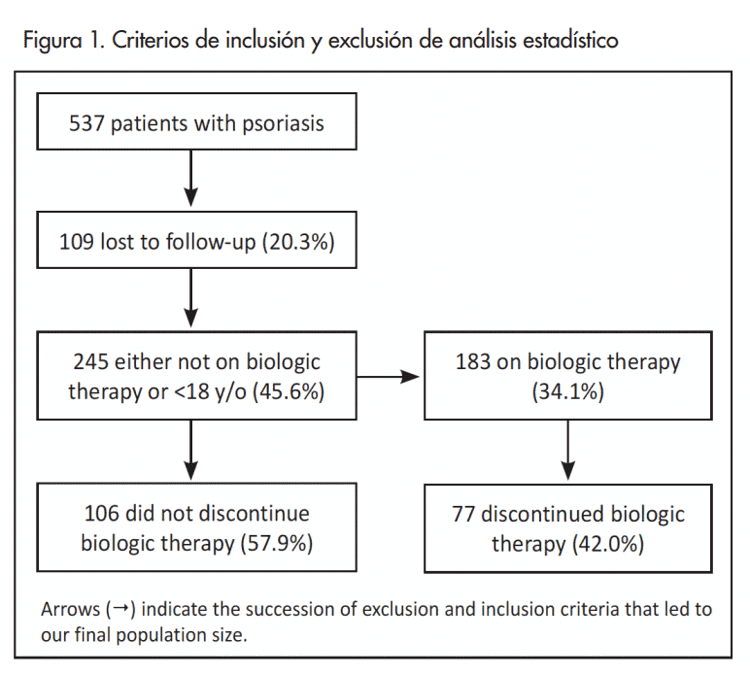
La duración de la terapia se informa en meses consecutivos de uso; por lo tanto, la duración de la terapia antes de una interrupción de más de 3 meses en esa terapia no se incluyó en la duración del tratamiento, lo cual es similar a lo que se ha hecho en otros ensayos (3,4). Se excluyeron los pacientes que no estaban en terapia biológica para su psoriasis o que no habían suspendido la terapia biológica. Como resultado de la revisión retrospectiva de historias clínicas, se identificaron un total de 537 pacientes con diagnóstico de psoriasis. Después de aplicar los criterios de exclusión e inclusión (Figura 1) a los registros, el personal del estudio analizó los datos de los que quedaron, todos los cuales eran de personas que habían discontinuado la terapia (n = 77).
Se realizó un análisis descriptivo, y los datos categóricos se resumieron como frecuencias con porcentajes, mientras que los datos continuos se resumieron con medidas de tendencia central y dispersión (frecuencia, media ± DE, mediana, valores mínimo y máximo). Se realizó una comparación de proporciones entre grupos (prueba exacta de Fisher); se realizó una comparación de medias mediante una prueba t. Todos los análisis estadísticos se evaluaron con un nivel de significación de dos colas de 0.05. El análisis estadístico se realizó utilizando el software STATA, v. 14.0.
Resultados
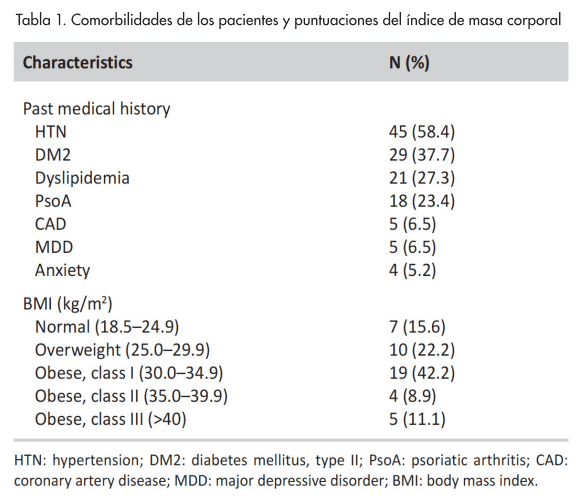
Se observó una edad media de 49.7 años, habiéndo identificado una mayoría femenina del 63.6% (n = 49). Un análisis de cuartil de edad reveló que la mayoría de los pacientes tenían entre 36 y 50 años (n = 25; 32.5 %) o entre 51 y 65 años (n = 26; 33.8 %), y el resto de los pacientes se distribuyeron uniformemente entre los grupos de edad de 18 a 35 años y mayores de 65 años (n = 13 [16.9%] para ambos grupos de edad). La hipertensión arterial (58.4%), la diabetes (37.7%), la dislipidemia (27.3%) y la artritis psoriásica (PsoA, 23.4%) fueron las principales comorbilidades observadas (tabla I). Las historias sociales y las puntuaciones del IMC estaban disponibles para 45 de los 77 pacientes incluidos. El consumo activo de alcohol o tabaco durante la terapia biológica se observó en el 6.7% y el 4.4% de los participantes, respectivamente. El IMC medio fue de 32.6 kg/m2, y la mayoría de los pacientes presentaban obesidad, clase I (42.2%) o sobrepeso (22.2%), como se muestra en la Tabla 1.
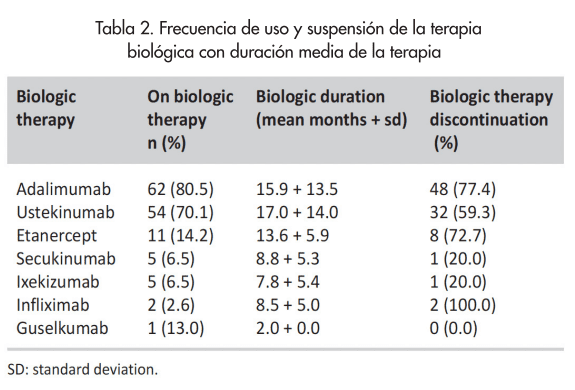
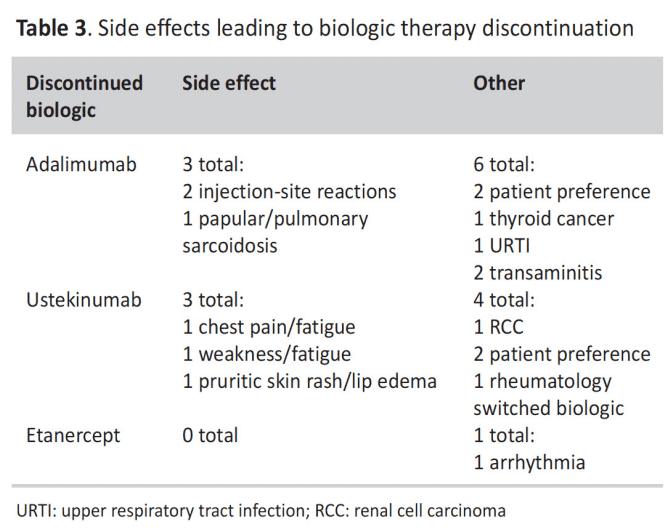
La Tabla 2 muestra la frecuencia del uso y la interrupción de la terapia biológica, así como la duración media de la terapia. Adalimumab (ADA), ustekinumab (UST) y etanercept (ETA) fueron los biológicos más utilizados (80.5%, 70.1% y 14.2%, respectivamente). El biológico con la duración media más larga antes de la suspensión fue UST (17,0 meses), seguido de ADA (15,9 meses) y ETA (13.6 meses). Los biológicos más discontinuados fueron ADA (77.4%), ETA (72.7%) y UST (59.3%). En la tabla IV se detallan los motivos de discontinuación, siendo la ineficacia la más común para todos los grupos biológicos, seguida por el hecho de que un determinado biológico no estaba cubierto por la compañía aseguradora de un determinado paciente. Los efectos secundarios que conducen a la interrupción de la terapia biológica se muestran en la Tabla 3, junto con otras razones para suspender la terapia biológica. Durante la revisión retrospectiva de EMR, las razones clasificadas bajo el término general “efectos secundarios” pudieron asociarse directamente con el uso biológico, mientras que las clasificadas bajo el término general “otros” no lo fueron. No se identificó un patrón significativo con los efectos secundarios informados asociados con la interrupción del tratamiento biológico.
La edad, el sexo, el IMC y las comorbilidades no se asociaron con la suspensión de ADA, ETA o UST (p > 0.05). De manera similar, la Tabla 4 demuestra la asociación estadísticamente significativa entre la ineficacia y la interrupción de ADA, UST y ETA (P < 0.001), mientras que la falta de cobertura de seguro para las 2 terapias biológicas relevantes se asoció significativamente con la interrupción de UST (P < .001) y ETA (p = .001).
Discusión
Nuestros datos describen la demografía y las comorbilidades de los pacientes con psoriasis que interrumpieron la terapia biológica al menos una vez. Este grupo tenía una edad media de 49.7 años, con predominio del sexo femenino (63.6%) y un IMC medio de 32.6 kg/m2, encontrándose la mayoría de los participantes con obesidad clase I (42.2%) o sobrepeso (22.2%), muy similar a lo encontrado por Kimball et al en su registro prospectivo multicéntrico de pacientes con psoriasis que estaban en tratamiento sistémico o biológico o eran candidatos a recibirlo (12). Nuestra población tuvo mayores frecuencias de hipertensión, diabetes tipo II, dislipidemia y PsoA en comparación con la cohorte de Kimball et a La CAD, que puede haber estado infra notificada en nuestra cohorte, fue la excepción a esta tendencia al aumento de las frecuencias (12). Heiss et al también notaron una mayor frecuencia de comorbilidades asociadas con la enfermedad cardíaca en hispanos en comparación con los caucásicos, lo que destaca la importancia de reforzar las opciones de estilo de vida saludable (p. ej., dieta y ejercicio, consultar a un nutricionista), así como de realizar un seguimiento adecuado y manejo de comorbilidades en hispanos con psoriasis (13).
En nuestra cohorte no se encontró una asociación significativa entre la interrupción de la terapia biológica y la edad, el género, las comorbilidades o el IMC. Reddy et al observaron una mayor supervivencia del fármaco (tiempo hasta la interrupción) en pacientes con PsoA, mientras que Warren et al no encontraron ninguna asociación entre la PsoA y la supervivencia del fármaco (3, 14). Tener un IMC superior a 35, ser fumador activo y usar ETA se han asociado con ineficacia, mientras que ser mujer y usar infliximab se ha asociado con eventos adversos (3). El aumento de la edad y un IMC alto se han asociado con la ineficacia de los inhibidores del TNF-alfa (TNFI) (15,16,17).
Con respecto a los predictores de interrupción de la terapia biológica, Zweegers et al observaron que las mujeres que usaban ADA y ETA tendían a sufrir más efectos secundarios que los pacientes masculinos y que las terapias de individuos con IMC alto que usaban ETA y UST tendían a ser ineficaces en comparación con las terapias de aquellos con BMIS más bajo (4). Honda et al encontraron puntajes más altos en el Índice de Severidad y Área de Psoriasis (PASI) al aumentar la edad y una asociación entre un PASI inicial alto y la interrupción general de la terapia biológica, aunque no encontraron ninguna asociación significativa entre la suspensión de UST o infliximab con la edad, el género , PASI basal o tabaquismo (2). El tabaquismo activo y/o el consumo de alcohol durante la terapia biológica pueden potencialmente disminuir la eficacia del tratamiento en la psoriasis al exacerbar la enfermedad subyacente (11).
En nuestra cohorte, ADA es el biológico más prescrito (80,5%), seguido de UST (70.1%) y ETA (14.2%), mientras que el más discontinuado es ADA (77.4%), seguido de ETA (72,7%) y UST (59.3%). Warren et al también observaron que había una mayoría de pacientes con ADA (53 %), con más casos de PsoA con TNFI que con UST (3). La interrupción de la terapia biológica se observó en el 42% de nuestros pacientes con psoriasis, y la ineficacia del tratamiento fue la razón más común que fue estadísticamente significativa para ADA, UST y ETA. De igual manera, la ineficacia (74,5%), seguida de los eventos adversos (21.6%), fue la principal razón para el cambio biológico en un estudio realizado por Honda et al (2). Otros autores han observado que ADA y UST se asocian con falla primaria (ineficacia observada desde el inicio de la terapia), mientras que infliximab se asocia con falla secundaria (mejoría inicial seguida de ineficacia) y reacciones en el lugar de la infusión (3, 19). En nuestra cohorte no se encontró una tendencia en términos de efectos secundarios que condujeran a la interrupción de la terapia biológica, aunque Zweegers et al encontraron una mayor frecuencia de efectos secundarios con el uso de ETA (51%), seguido de ADA (38%) y luego UST (11%) con infecciones (en su mayoría de origen en las vías respiratorias superiores) que conducen principalmente a la interrupción de ADA y ETA, pero no de UST (4). En nuestro estudio, el hecho de que las terapias biológicas no estén universalmente cubiertas por las compañías de seguros también se asoció significativamente con la suspensión de ETA y UST. Algunos autores han opinado que los costes asociados a la terapia biológica pueden ser una de las razones por las que los pacientes abandonan el tratamiento biológico (1). En nuestra cohorte, UST tuvo la duración media más larga de la terapia (17 meses) antes de su interrupción; le siguieron ADA (15.9 meses) y ETA (13.6 meses). En otros estudios (3, 4) se informó una supervivencia superior del fármaco con UST (en comparación con otros agentes biológicos). Con respecto a la eficacia y los efectos secundarios, estudios previos informaron una mayor supervivencia del fármaco en el grupo UST en comparación con los grupos ADA y ETA después de corregir los factores de confusión, mientras que no se encontraron diferencias significativas entre los grupos ADA y ETA (4). Sin embargo, ADA ha demostrado la mayor supervivencia del fármaco dentro del grupo TNFI (3).
La tasa superior de supervivencia del fármaco de UST en comparación con las tasas de TNFI puede explicarse por su mayor eficacia (20), menor inmunogenicidad (21) y perfil adecuado de efectos secundarios, así como el hecho de que tiende a ser preferido por los pacientes. debido a la disminución del régimen de dosificación y su forma de administración (3). Las diferencias en la presentación clínica, el pronóstico, la comunicación de los síntomas y los resultados del tratamiento se han propuesto como posibles explicaciones de que las mujeres se asocian con efectos secundarios que conducen a la finalización prematura del tratamiento (22). La inmunogenicidad puede conducir a una disminución de la eficacia de la terapia biológica con el tiempo y se ha informado que es tan alta como 19.5 a 51.5 % para infliximab, 4 a 46 % para ADA, 1.1 a 18.3 % para ETA y 3.8 a 5.1 % para UST ( 21). Las moléculas quiméricas como el infliximab contienen porciones murinas y son más inmunogénicas que otros anticuerpos humanizados (ADA, UST y ETA, por ejemplo) (23, 24,25).
Este estudio está limitado por su naturaleza retrospectiva; por lo tanto, está sujeto al sesgo de recuerdo, así como al sesgo de informe. En general, las evaluaciones de EMR no hicieron un uso consistente de objetivos medidas, como el cambio desde el valor inicial en el porcentaje de área de superficie corporal involucrada o las puntuaciones PASI, para determinar la eficacia del tratamiento. Este estudio está limitado por la naturaleza subjetiva de determinar el fracaso de la terapia biológica en función de las evaluaciones de la respuesta al tratamiento por parte del médico y del paciente. Además, se trata de un tamaño de muestra pequeño, sujeto a sesgos de selección y de derivación, ya que la población de estudio procedía de un único centro de tercer nivel. Los estudios adicionales deben comparar a los pacientes con psoriasis que requirieron un cambio en la terapia biológica versus aquellos que no lo requirieron y comparar, también, las tasas de supervivencia de los medicamentos de las terapias biológicas disponibles y enfocarse en estudios prospectivos más amplios para determinar el impacto de las características de un paciente dado en su decisión de suspender la terapia biológica. Por último, los pacientes pueden ser menos comunicativos sobre el consumo de tabaco (18) y/o alcohol durante los encuentros clínicos, lo que podría explicar las bajas frecuencias de consumo de alcohol y tabaco notificadas en nuestra cohorte.
Conclusión
La ineficacia biológica se identificó como la razón más común para suspender la terapia biológica en todos los grupos de fármacos y fue estadísticamente significativa para ADA, UST y ETA. Sin embargo, no se encontraron asociaciones estadísticamente significativas entre la suspensión de la terapia biológica y la edad, el IMC, el sexo o las comorbilidades, mientras que la falta de cobertura por parte de algunas compañías de seguros se asoció significativamente con la suspensión de ETA y UST. La identificación de las características de los pacientes como posibles factores de riesgo para la interrupción prematura de la terapia biológica puede disminuir la morbilidad asociada con el fracaso de la terapia biológica en pacientes con psoriasis y mejorar los resultados clínicos.
RESUMEN
Objetivo: El objetivo es describir la frecuencia de la interrupción de la terapia biológica en pacientes con psoriasis y las características asociadas al fallo del tratamiento.
Métodos: Una revisión retrospectiva de los registros médicos de pacientes con psoriasis evaluados entre el 1 de enero del 2013 y el 1 de mayo del 2018 que fallaron con tratamientos biológicos al menos una vez.
Resultados: Setenta y siete pacientes con psoriasis que descontinuaron las terapias biológicas fueron incluidos. Se describió la prevalencia de hipertensión (58.4%), diabetes (37.7%), dislipidemia (27.3%) y artritis psoriásica (23.4%). Adalimumab (ADA, 80.5%), Ustekinumab (UST, 70.1%) y Etanercept (ETA, 14.2%) fueron los biológicos más utilizados. El con mayor tiempo biológico de uso fue UST (17 meses), seguido por ADA (15.9 meses) y ETA (13.6 meses). Conclusión: Factores como la ineficacia del tratamiento biológico y la falta de cubierta de plan médico se asociaron al fallo terapéutico con biológicos en la cohorte. No hubo asociación entre la edad, el género o las comorbilidades del paciente y la interrupción de la terapia biológica. Se necesitan estudios de poblaciones más grandes para identificar factores de riesgo asociados a la interrupción de la terapia biológica en pacientes con psoriasis.
Esta información podrá guiar la selección de terapia biológica, disminuir la morbilidad asociada a la falla terapéutica y mejorar el pronóstico clínico de pacientes con psoriasis.
REFERENCIAS
1. Foster SA, Zhu B, Guo J, et al. Patient Characteristics, Health Care Re-source Utilization, and Costs Associated with Treatment-Regimen Failure with Biologics in the Treatment of Psoriasis. J Manag Care Spec Pharm. 2016;22(4):396-405. doi:10.18553/ jmcp.2016.22.4.396
2. Honda H, Umezawa Y, Kikuchi S, et al. Switching of biologics in psoriasis: Reasons and results. J Dermatol. 2017;44(9):1015- 1019. doi:10.1111/1346-8138.13860
3. Warren RB, Smith CH, Yiu ZZN, et al. Differential Drug Survival of Biologic Therapies for the Treatment of Psoriasis: A Prospective Ob-servational Cohort Study from the British Association of Dermatolo-gists Biologic Interventions Register (BADBIR). J Invest Dermatol. 2015;135(11):2632-2640. doi:10.1038/ jid.2015.208
4. Zweegers J, van den Reek JM, van de Kerkhof PC, et al. Body mass index predicts discontinuation due to ineffectiveness and female sex predicts discontinuation due to side-effects in patients with psoriasis treated with adalimumab, etanercept or ustekinumab in daily practice: a prospective, comparative, long-term drug-survival study from the BioCAPTURE reg-istry. Br J Dermatol. 2016;175(2):340-347. doi:10.1111/bjd.14552
5. Gniadecki R, Bang B, Bryld LE, Iversen L, Lasthein S, Skov L. Comparison of long-term drug survival and safety of biologic agents in patients with psoriasis vulgaris. Br J Dermatol. 2015;172(1):244- 252. doi:10.1111/bjd.13343
6. Gniadecki R, Kragballe K, Dam TN, Skov L. Comparison of drug survival rates for adalimumab, etanercept and infliximab in patients with psoriasis vulgaris. Br J Dermatol. 2011;164(5):1091-1096. doi:10.1111/j.1365-2133.2011.10213.x
7. van den Reek JMPA, Kievit W, Gniadecki R, et al. Drug Survival Stud-ies in Dermatology: Principles, Purposes, and Pitfalls. J Invest Dermatol. 2015;135(7):1-5. doi:10.1038/jid.2015.171
8. Menter A, Papp KA, Gooderham M, et al. Drug survival of biologic therapy in a large, disease-based registry of patients with psoriasis: results from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). J Eur Acad Dermatol Venereol. 2016;30(7):1148-1158. doi:10.1111/jdv.13611
9. Vincent FB, Morand EF, Murphy K, Mackay F, Mariette X, Marcelli C. Antidrug antibodies (ADAb) to tumour necrosis factor (TNF)-specific neutralising agents in chronic inflammatory diseases: a real issue, a clini-cal perspective. Ann Rheum Dis. 2013;72(2):165-178. doi:10.1136/an-nrheumdis-2012-202545
10. Chaparro M, Guerra I, Muñoz-Linares P, Gisbert JP. Systematic re-view: antibodies and anti-TNF-a levels in inflammatory bowel disease. Aliment Pharmacol Ther. 2012;35(9):971-986. doi:10.1111/j.1365-2036.2012.05057.x
11. Hayes J, Koo J. Psoriasis: depression, anxiety, smoking, and drinking habits. Dermatol Ther. 2010;23(2):174-180. doi:10.1111/j.1529- 8019.2010.01312.x
12. Kimball AB, Leonardi C, Stahle M, et al. Demography, baseline disease characteristics and treatment history of patients with psoriasis enrolled in a multicenter, prospective, disease-based registry (PSOLAR). Br J Der-matol. 2014;171(1):137-147. doi:10.1111/bjd.13013
13. Heiss G, Snyder ML, Teng Y, et al. Prevalence of metabolic syndrome among Hispanics/Latinos of diverse background: the Hispanic Commu-nity Health Study/Study of Latinos. Diabetes Care. 2014;37(8):2391-2399. doi:10.2337/dc13-2505
14. Reddy SP, Lin EJ, Shah VV, Wu JJ. Persistence and failure rates of adalim-umab monotherapy in biologic-naïve patients with psoriasis: A retrospec-tive study. J Am Acad Dermatol. 2016;74(3):575- 577. doi:10.1016/j. jaad.2015.11.005
15. Menter A, Gordon KB, Leonardi CL, Gu Y, Goldblum OM. Efficacy and safety of adalimumab across subgroups of patients with moderate to se-vere psoriasis. J Am Acad Dermatol. 2010;63(3):448- 456. doi:10.1016/j. jaad.2009.09.040
16. Di Lernia V, Tasin L, Pellicano R, Zumiani G, Albertini G. Impact of body mass index on retention rates of anti-TNF-alfa drugs in daily practice for psoriasis. J Dermatolog Treat. 2012;23(6):404-409. doi:10.3109/09546 634.2011.593489
17. Di Lernia V, Ricci C, Lallas A, Ficarelli E. Clinical predictors of non-response to any tumor necrosis factor (TNF) blockers: a retrospective study. J Dermatolog Treat. 2014;25(1):73-74. doi:10.3109/09546634.2 013.800184
18. Burris JL, Studts JL, DeRosa AP, Ostroff JS. Systematic Review of To-bacco Use after Lung or Head/Neck Cancer Diagnosis: Results and Rec-ommendations for Future Research. Cancer Epidemiol Biomarkers Prev. 2015;24(10):1450-1461. doi:10.1158/1055-9965.EPI-15-0257
19. Umezawa Y, Nobeyama Y, Hayashi M, et al. Drug survival rates in patients with psoriasis after treatment with biologics. J Dermatol. 2013;40(12):1008-1013. doi:10.1111/1346- 8138.12353
20. Griffiths CE, Strober BE, van de Kerkhof P, et al. Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. N Engl J Med. 2010;362(2):118-128. doi:10.1056/NEJMoa0810652
21. Carrascosa JM, van Doorn MB, Lahfa M, Nestle FO, Jullien D, Prinz JC. Clinical relevance of immunogenicity of biologics in psoriasis: implications for treatment strategies. J Eur Acad Dermatol Venereol. 2014;28(11):1424-1430. doi:10.1111/ jdv.12549
22. Teunissen TAM, Rotink ME, Lagro-Janssen ALM. Gender differences in quality of care experiences during hospital stay: A contribution to pa-tient-centered healthcare for both men and women. Patient Educ Couns. 2016;99(4):631-637. doi:10.1016/j.pec.2015.10.033
23. De Groot AS, Terry F, Cousens L, Martin W. Beyond humanization and de-immunization: tolerization as a method for reducing the immunoge-nicity of biologics. Expert Rev Clin Pharmacol. 2013;6(6):651-662. doi: 10.1586/17512433.2013.835698
24. Emi Aikawa N, de Carvalho JF, Artur Almeida Silva C, Bonfá E. Im-munogenicity of Anti-TNF-alpha agents in autoimmune diseases. Clin Rev Allergy Immunol. 2010;38(2-3):82-89. doi:10.1007/ s12016-009-8140-3
25. Lombardi G, Perego S, Sansoni V, Diani M, Banfi G, Altomare G. Anti-adalimumab antibodies in psoriasis: lack of clinical utility and labora-tory evidence. BMJ Open. 2016;6(12):e011941. Published 2016 Dec 9. doi:10.1136/bmjopen-2016-011941