Los dominios más afectados en EM son velocidad de procesamiento de información principalmente memoria del trabajo y atención.

La esclerosis múltiple (EM) ha sufrido modificaciones en su clasificación con base en la presencia o no de actividad y presencia o no de progresión. Esta progresión determinada por escalas como la EDSS (Escala ampliada del estado de discapacidad) y en el aspecto cognitivo por el MSCF (Compuesto funcional de la esclerosis múltiple), SDMT (Prueba de modalidades de dígitos simbólicos) y BICAMS (Breve evaluación cognitiva internacional de la EM).
Diversas medidas por estudio de imagen como atrofia cerebral han mostrado clara correlación con progresión y discapacidad. El panorama parece prometedor, ya que los nuevos fármacos han mostrado eficacia en disminuir dicha atrofia y la progresión de discapacidad.
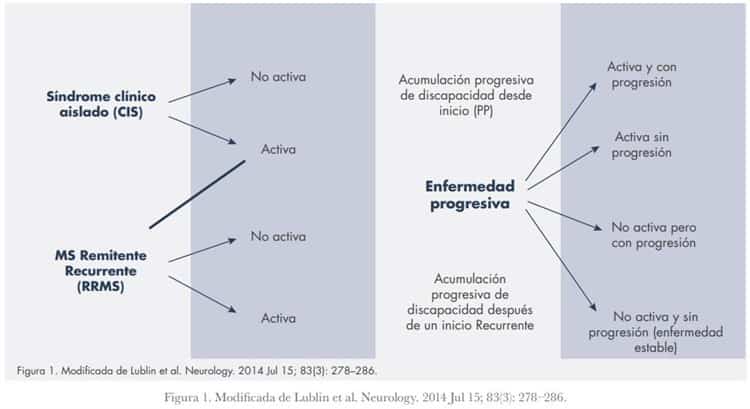
Esclerosis múltiple (EM) es una condición mediada por el sistema inmune que afecta a cerca de un millón de personas en los Estados Unidos de Norte América (1) y es la primera causa de discapacidad física en adultos jóvenes. Por varios años MS había sido subclasificada en: síndrome clínico aislado (CIS), remitente recurrente (RR), secundaria progresiva (SP), primaria progresiva (PP) y progresiva recurrente (PR).
Fue hasta 2013 cuando el “International MS Phenotype Group” revisaron dichos criterios y separándolos en: inflamación activa (recaídas clínicas o lesiones nuevas o activas en Resonancia Magnética (MRI)) o progresión clínica gradual e insidiosa(2), eliminando completamente el concepto de enfermedad progresiva con recaídas.
Históricamente los fármacos modificadores de la enfermedad (DMD por sus siglas en inglés) han mostrado, a través ensayos clínicos, éxito en la mejoría de la inflamación o la actividad de la condición, ya sea reduciendo el número de recaídas, el número de lesiones nuevas T2 o lesiones nuevas que capten contraste.
Sin embargo, no han sido tan exitosos en la disminución de la progresión de la discapacidad, especialmente cuando la condición se torna no activa y a esto se ha buscado una explicación y quizás tenga que ver con diversos mecanismos envueltos en esa progresión de discapacidad.
Mientras que en la enfermedad Remitente Recurrente (RR) suele haber una disrupción de la barrera hematoencefálica(HE) con infiltración de células inflamatorias y subsecuente desmielinización y daño axonal, que se ve reflejado típicamente en nuevas lesiones y lesiones activas en el MRI(3).
En la fase progresiva se habla más de una inflamación “compartimentada” donde la barrera HE no es permeable y donde otras células, por ejemplo las células B, se ven envueltas formando agregados meníngeos linfoides en forma de folículos(4) los cuales están asociados con las lesiones corticales y, secundariamente, con la pérdida de sustancia gris(5).
La pérdida de tejido debido a la inflamación y desmielinización típica de la EMRR puede ser parcialmente reversible mientras que la pérdida de tejido y daño axonal por otros mecanismos, diferentes a la inflamación, es irreversible siendo el principal componente de la atrofia cerebral, primordialmente en la etapa progresiva de la enfermedad y es, quizás, la principal causa de discapacidad permanente en EM(6). Además de la inflamación otros mecanismos están envueltos:

Creada desde 1983 por el Dr. Kurtzke, la escala ampliada del estado de discapacidad (EDSS) (8) (tabla 1) ha sido utilizada como una medida estandarizada en la mayoría de los ensayos clínicos de EM. Basada en la evaluación de 8 sistemas funcionales(1 Piramidal, 2 Cerebelar, 3 Tallo Cerebral,4 Sensorial, 5 vejiga e intestino, 6 Visual (óptico), 7 Cerebral (cognitivo), 8 Otras funciones) y en un puntaje que va del 0 (no discapacidad ) a 10 (muerte debida a EM), ha sido criticada constantemente por ser una escala que se basa principalmente en la deambulación y evalúa someramente otros aspectos como el cognitivo.(9)
El daño cognitivo se presenta del 45 % hasta el 65% de los pacientes con EM(10) y en varios pacientes puede progresar independientemente de la discapacidad física. Los dominios más afectados en EM son velocidad de procesamiento de información (principalmente memoria del trabajo) y atención.
Dadas las limitaciones del EDSS, en la mayoría de los estudios se han utilizado varias baterías de evaluación. El Multiple Sclerosis Functional Composite (MSFC) que incluye varios aspectos como función de extremidades inferiores (Caminada de 25 pies), destreza de extremidades superiores (9-hole peg test) y velocidad de procesamiento y atención con el PASAT (paced auditory serial addition test), recientemente sustituido por el SDMT (symbol digit modality test) que evalúa la velocidad de procesamiento con figuras y símbolos y otra prueba como las tablas de agudeza de bajo contraste para evaluación visual. (10, 11,12).
Nuevas baterías de rápida realización hasta en 15 min como el “Brief International Cognitive Assessment for MS (BICAMS)” están ahora siendo utilizadas. De hecho, estudios recientes afirman que aplicar el SDMT y el Brief Visuospatial Memory Test-Revised (BVMT-R) es una alternativa recomendable en menos tiempo y con alta sensibilidad diagnóstica.(19))
La atrofia cerebral global en EM tiene una asociación significativa con el grado de discapacidad medida por el EDSS(13). Los estudios de imagen pueden ser un marcador potencial de progresión subclínica, ya sea de atrofia global, talámica, hipocampo de núcleo caudado o de cordón espinal que se aprecia incluso desde el CIS o síndrome radiológico aislado (RIS) (14) y la tasa de atrofia inicial predice la discapacidad a 8 años(15).
Diversas técnicas de imagen han sido utilizadas desde el MRI de alta definición, secuencia de “Double Inversion Recovery” (DIR), “Contrast magnetization transfer ratio” (MTR), Imagen de Difusión pesada (DWI), Imagen Por Tensor de Difusión (DTI), Espectroscopía por Resonancia Magnética (MRS), Tomografía por Emisión de positrones (PET) e incluso para evaluación de nervio óptico por Tomografía de Coherencia Óptica (OCT) que se ha corelacionado con marcadores por MRI de atrofia cerebral y ha mostrado ser un buen marcador de neurodegeneración(16). Varios estudios han demostrado correlación entre la cantidad de “black holes” y discapacidad clínica, así como la presencia de lesiones corticales(17).
La atrofia cerebral es una medida válida y sensible de carga de la enfermedad y progresión que será utilizada como parámetro en los ensayos clínicos.
Pocas escalas han sido utilizadas para la medición de la discapacidad clínica siendo el EDSS la más consistente, varias baterías han demostrado medir eficazmente los dominios más afectados en EM.
Diversas técnicas de imagen han mostrado eficazmente medir la atrofia cerebral y en cordón y su correlación con progresión de discapacidad.
Pero otros factores juegan un papel importante como: ser hombre, lesiones en cordón espinal, tabaquismo, obesidad y niveles bajos de vitamina D3, algunos de ellos modificable, junto con un estilo de vida activo, una dieta predominantemente tipo mediterránea y terapia física, se sugiere puede ayudar a crear una reserva funcional del sistema nervioso resistente a daño(18).
En cuanto a medicamentos, el panorama parece ser más prometedor con medicamentos que han mostrado disminuir la progresión de discapacidad como Siponimod, Ocrelizumab y Ofatumumab entre otros, algunos han mostrado clara reducción en la tasa de atrofia cerebral como Teriflunomide y Ozanimod entre otros.
1. National Multiple Sclerosis Society. MS prevalence. nationalmssociety.org/About-the-Society/MS-Prevalence. Accessed September01,2020.
2. Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiplesclerosis: the 2013 revisions. Neurology 2014;83(3):278Y286.
3. Popescu F G, Lucchinetti C, Ann Rev Pathol Mech Dis 7(2012)185-217.
4. Serafini B, Rosicarelli B, Magliozzi R, et al.Detection of ectopic B-cell follicles with germinal centers in the meninges of patients with secondary progressive multiple sclerosis.BrainPathol 2004;14(2):164–174.
5. Howell OW, Reeves CA, Nicholas R, et al.Meningeal inflammation is widespread and
6. linked to cortical pathology in multiple sclerosis.Brain 2011;134(pt 4):2755–2771.
7. Andravizou A, Dardiotis E. Brain atrophy in multiple sclerosis: mechanisms, clinical relevance and treatment options. Immun Highlights. 2019 Aug 10;10(1):7. Ontaneda D. CONTINUUM (MINNEAP MINN)2019;25(3, MULTIPLE SCLEROSIS AND OTHER CNS INFLAMMATORYDISEASES):736–752.
8. Kurtzke JF. Rating neurologic impairment in multiple sclerosis: An expanded disability status scale (EDSS). Neurology (Cleveland) 1983; 33:1444–1452.
9. Piri Çinar B, GüvenYorgun Y. What We Learned from The History of Multiple Sclerosis Measurement: Expanded Disability Status Scale. Arch Neuropsychiatry 2018;55: (Suppl 1): S69-S75.
10. Rao SM, Leo GJ, Bernardin L, Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology 1991; 41:685–691.
11. PrakashRS, Snook EM, et al. Cognitive impairments in relapsing-remitting multiple sclerosis: a meta-analysis. Multiple Sclerosis 2008; 14: 1250–1261
12. Benedict RH, Amato MP, Boringa J, Brochet B, Foley F, Fredrikson S, Hamalainen P, Hartung H, Krupp L, Penner I, Reder AT, Langdon D. Brief international cognitive assessment for MS (BICAMS): international standards for validation. BMC Neurol 2012;12:55.
13. Zivadinov R, Bakshi R. Central nervous system atrophy and clinical status in multiple sclerosis. J Neuroimaging. 2004;14(3 Suppl):27s–35s.
14. Azevedo CJ, Overton E, Khadka S, et al. Early CNS neurodegeneration in radiologically isolated syndrome. Neurol NeuroimmunolNeuroinflamm 2015;2(3): e102.
15. Zieman U, et al. of biomarkers for multiple sclerosis as a neurodegenerative disorder. Progress in Neurobiology 95 (2011) 670–685.
16. Galetta, KM, Calabresi P, Frohman E. Optical Coherence Tomography (OCT): Imaging the Visual Pathway as a Model for Neurodegeneration. The Journal of the American Society for Experimental NeuroTherapeutics. Vol. 8, 117-132, January 2011
17. Calabrese M, AgostaF,Cortical Lesions and Atrophy Associated With Cognitive Impairment in Relapsing-Remitting Multiple Sclerosis. Arch Neurol. 2009;66(9):1144-1150.
18. Kantarci O H,Phases and Phenotypes of Multiple Sclerosis. CONTINUUM (MINNEAP MINN)2019;25(3, MULTIPLE SCLEROSISAND OTHER CNS INFLAMMATORYDISEASES):636–654.
19. Baetge S J, FilserM, etal.On the validity of single tests, two-test combinations and the full Brief International Cognitive Assessment for Multiple Sclerosis (BICAMS) in detecting patients with cognitive impairment. MultScler. 2019 Nov 19; 1-10.