Es necesario conocer el tiempo esperado para que las terapias induzcan una mejoría y remisión sintomáticas para determinar el momento del seguimiento, la (re)evaluación de la enfermedad y la duración de la persistencia con las terapias.
Es necesario conocer el tiempo esperado para que las terapias induzcan una mejoría y remisión sintomáticas para determinar el momento del seguimiento, la (re)evaluación de la enfermedad y la duración de la persistencia con las terapias, sin embargo, esto rara vez se informa como un resultado en los ensayos clínicos. En esta revisión, exploramos el tiempo hasta la respuesta clínica y la remisión de los tratamientos actuales para la enfermedad inflamatoria intestinal (EII), así como la medicación, el paciente y los factores relacionados con la enfermedad que pueden influir en el tiempo hasta la respuesta clínica.Parece que el tiempo hasta la respuesta terapéutica varía dependiendo de la indicación de la terapia (enfermedad de Crohn o colitis ulcerosa). Los agentes con el tiempo más rápido hasta la respuesta clínica incluyeron corticosteroides, inhibidores de la calcineurina, nutrición enteral exclusiva, aminosalicilatos y terapia con factor de necrosis tumoral que funcionará en la mayoría de los pacientes dentro de los primeros 2 meses. El vedolizumab, el metotrexato y las tiopurinas tuvieron un tiempo más largo hasta la respuesta clínica y pueden tardar varios meses en lograr la máxima eficacia. Los factores que afectan el tiempo hasta la respuesta clínica de las terapias incluyeron el uso de terapia concomitante, la duración de la enfermedad, el tabaquismo, el fenotipo de la enfermedad y la edad avanzada. Parece haber una marcada variación en el tiempo hasta la respuesta clínica para las terapias utilizadas en la EII, que está influenciada aún más por la enfermedad y los factores relacionados con el paciente. Comprender el tiempo esperado para la respuesta terapéutica es integral para informar la toma de decisiones adicionales, mantener un enfoque centrado en el paciente y garantizar que el tratamiento reciba un marco de tiempo adecuado para lograr el máximo beneficio antes del abandono.
Palabras clave: Enfermedad de Crohn, Farmacología clínica, Colitis ulcerosa, Tiopurinas, Enfermedad inflamatoria intestinal, Productos biológicos, Nutrición
Consejo básico: Parece haber una marcada variación en el tiempo hasta la respuesta clínica para las terapias utilizadas en la enfermedad inflamatoria intestinal, que está influenciada aún más por la enfermedad y los factores relacionados con el paciente. La respuesta más rápida se puede esperar con corticosteroides, inhibidores de calcineurina, nutrición enteral exclusiva, aminosalicilatos y terapia con factor de necrosis antitumoral (dentro de los 2 meses), mientras que el metotrexato, las tiopurinas y el vedolizumab pueden tardar varios meses en lograr la respuesta máxima. Hay una falta de informe del tiempo hasta la respuesta de las terapias en los ensayos clínicos para la enfermedad inflamatoria intestinal y esta sigue siendo un área que debe abordarse en estudios futuros.
Introducción
El arsenal terapéutico para la enfermedad inflamatoria intestinal (EII), que comprende la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), continúa expandiéndose, brindando valiosas oportunidades adicionales para lograr resultados óptimos a largo plazo para los pacientes. Igualmente, sin embargo, hay una complejidad adicional, proporcional al número de opciones, una mejor comprensión de los riesgos y beneficios, además de los efectos diferenciales de los tratamientos sobre los resultados objetivos de la enfermedad (p. ej., cicatrización de la mucosa), la remisión clínica o los resultados informados por los pacientes.
Sin embargo, cuando se pueden lograr mejores resultados, hay expectativas más altas. Es cada vez más importante con la terapéutica actual que el médico planifique con anticipación, dado que los retrasos en la escalada del tratamiento son probablemente tan comunes y perjudiciales como los retrasos en el diagnóstico en la EII[1]. Por lo tanto, la conciencia del tiempo aproximado esperado para lograr un objetivo de tratamiento es fundamental para tomar decisiones tales como si persistir con una terapia o cambiar a una alternativa. Del mismo modo, uno le hace un flaco favor a su paciente al cambiar prematuramente las terapias antes de que a un agente se le dé un período de tiempo adecuado para lograr la eficacia.
Lograr un tiempo óptimo para la respuesta terapéutica tiene más beneficios en la relación médico-paciente, ya que le permite al médico proporcionar al paciente un marco convincente del período esperado para ver la respuesta a un nuevo medicamento y, con suerte, capacitar al paciente para perseverar y mantener la adherencia a la terapia. Esto es particularmente relevante para las terapias que tienen un tiempo más largo para la respuesta terapéutica, como los inmunomoduladores, donde puede tomar varios meses alcanzar la máxima eficacia terapéutica sin que el paciente necesariamente experimente ningún beneficio de los síntomas durante una parte significativa de esto.
Por lo tanto, el tiempo hasta la respuesta terapéutica es un factor importante pero subestimado en el tratamiento diario de la EII y no ha sido un foco importante de atención en la literatura hasta la fecha. Esta revisión intenta abordar esta necesidad insatisfecha mediante el análisis de la bibliografía disponible relacionada con el tiempo esperado hasta la respuesta clínica para los tratamientos actualmente disponibles en la EII y las medidas que pueden ayudar al médico a determinar si un fármaco ha alcanzado su potencial terapéutico. También analizaremos la enfermedad y los factores relacionados con el paciente que pueden afectar el tiempo de respuesta clínica de las terapias. Los tratamientos analizados en la revisión incluirán corticosteroides, aminosalicilatos (5-ASA), tiopurinas, metotrexato, tratamientos antifactor de necrosis tumoral (anti-TNF), vedolizumab, inhibidores de la calcineurina y nutrición enteral exclusiva.
DEFINICIÓN DEL TIEMPO HASTA LA RESPUESTA CLÍNICA Y LA REMISIÓN
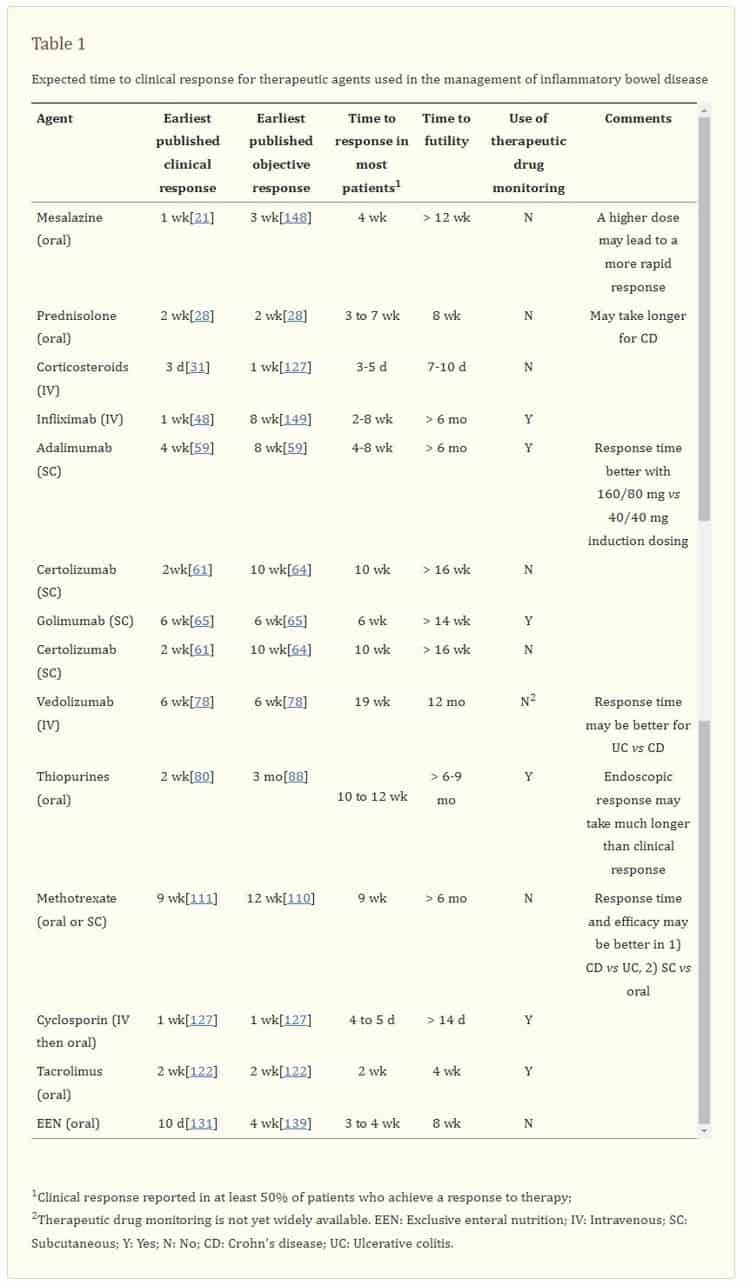
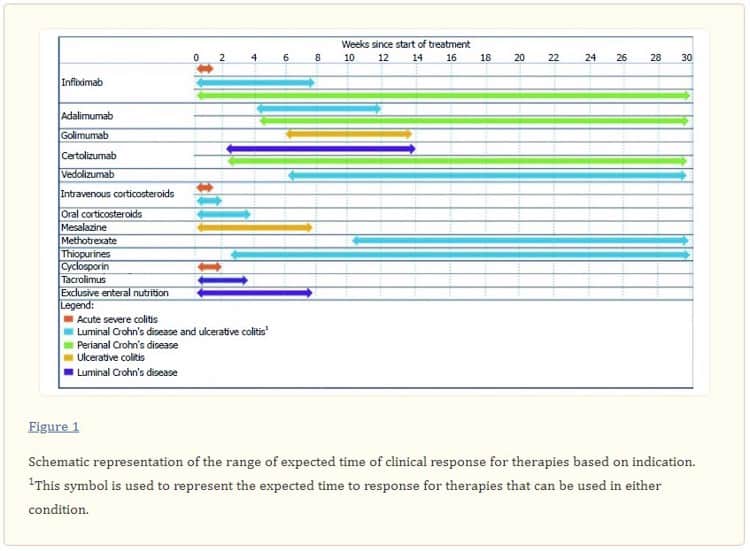
El concepto de tiempo hasta la respuesta clínica se representa esquemáticamente en la figura 1.1. Dada la falta de enfoque en el tiempo de respuesta en la literatura previa, no existe una definición ampliamente aceptada. En el cuadro 11 figura un resumen de algunos de los componentes importantes del tiempo de respuesta. Estos incluyen el momento más temprano en el que un paciente puede esperar una respuesta, el momento en que la mayoría de los pacientes (es decir, más del 50%) que esperan beneficiarse de la terapia lograrán una respuesta y el punto de tiempo donde el beneficio terapéutico sigue siendo improbable, el llamado tiempo para la futilidad. Para esta revisión, el tiempo hasta la respuesta clínica se refiere al tiempo desde el inicio del tratamiento hasta que el paciente logra una respuesta clínica. Solo se refiere a los pacientes que logran una respuesta clínica y, por lo tanto, puede ayudar al médico a juzgar la probabilidad de que se logre una respuesta en función del tiempo transcurrido en la terapia. Cuando estén disponibles, se informarán estimaciones de los plazos en los que se espera que la mayoría de los pacientes que finalmente responden a la terapia respondan a la terapia. El tiempo hasta la inutilidad del tratamiento se informa en la Tabla 1,1, sin embargo, este no será un enfoque principal de esta revisión.
Los métodos para determinar cuándo se ha producido una "respuesta" son heterogéneos e incluyen tanto síntomas clínicos como hallazgos endoscópicos (o evaluados objetivamente). La correlación entre la mejoría sintomática y el logro de la remisión endoscópica difiere entre la CU y la EC, con una mejoría en los síntomas que se correlaciona mejor con la curación de la mucosa en la CU que en la EC[2-5]. Hay datos para apoyar la remisión clínica temprana, aunque no la respuesta, para predecir la mejoría endoscópica y la curación a los 12 meses[6]. Sin embargo, el valor de la mejoría sintomática no se puede descartar desde la perspectiva del paciente dada la correlación con la remisión libre de esteroides a largo plazo y la parte inherente que desempeña el alivio de los síntomas en la mejora de la calidad de vida [5,7]. Además, la compleja interacción de los síntomas del paciente y el daño estructural en la EII se reconoce cada vez más, con síntomas y hallazgos endoscópicos importantes para determinar la gravedad y la carga general de la enfermedad[8].
Debido a la heterogeneidad entre los estudios para definir la respuesta clínica, la remisión clínica y la remisión endoscópica, se utilizaron medidas de resultado amplias de "mejoría clínica o endoscópica" o "remisión clínica o endoscópica o cicatrización de la mucosa" según lo definido por los autores de cada estudio. Para el propósito de esta revisión, la respuesta clínica considerará la mejoría de los síntomas solamente en lugar de una mejoría en los síntomas y los índices de laboratorio.
En la Tabla 11 y la Figura 1.1 se presenta un resumen del tiempo relativo hasta la respuesta terapéutica de las diferentes terapias para la EII. Los factores relacionados con la medicación que influyen en el tiempo de respuesta de las diferentes terapias se discuten dentro de cada una de las clases terapéuticas.
AMINOSALICILATOS
Tiempo hasta la respuesta clínica
Los aminosalicilatos son más efectivos para inducir la respuesta y la remisión en pacientes con colitis ulcerosa leve a moderada que el placebo[9], pero su evidencia de eficacia en pacientes con enfermedad de Crohn es pobre[10,11]. Por lo tanto, con respecto a la colitis ulcerosa, los datos disponibles indican que generalmente se necesitan de dos a cuatro semanas para lograr una respuesta clínica con aminosalicilatos orales y / o tópicos. La mesalazina induce la remisión endoscópica en el 67% de los pacientes a las 4 semanas para la colitis activa para preparaciones de 2 y 4 g, mientras que otro estudio encontró tasas de remisión endoscópica más altas del 78% y 69% después de 8 semanas con mesalazina multimatriz 4.8 g y 2.4 g, respectivamente, lo que sugiere que algunos pacientes que lograrán la remisión endoscópica pueden tomar hasta 8 semanas [12,13].
Factores relacionados con la terapia que afectan el tiempo de respuesta
Las cuestiones clave para los aminosalicilatos incluyen si la formulación, la dosis y / o la(s) vía(s) de administración influyen en la velocidad de inicio de la acción.
Formulación: Los ensayos de sulfasalazina, olsalazina y balsalazida en CU leve a moderada demostraron una mejoría en los síntomas clínicos y la respuesta endoscópica con 2 a 3 semanas de terapia en la mayoría de los pacientes [14-17]. En contraste, según los datos publicados, las preparaciones de mesalazina recubiertas demostraron una mejoría clínica y endoscópica algo más lenta dentro de 4 a 8 semanas[18,19]. Dos estudios directos sugirieron que una dosis equimolar de balsalazida resultó en una respuesta clínica y endoscópica más rápida que la terapia con mesalazina de liberación retardada (usando tabletas recubiertas con Eudragit S) para pacientes con enfermedad del lado izquierdo [17,20].
Dosis: El tiempo hasta la respuesta terapéutica para los aminosalicilatos también puede depender de la dosis, como lo demostraron Orchard et al[21] quienes encontraron que 4.8 g diarios de mesalazina (liberación retardada, Asacol MR®) mejoraron y resolvieron los síntomas más rápidamente que 2.4 g diarios (mediana 7 d vs 9 d, 19 d vs 29 d respectivamente). Otro estudio encontró un tiempo de respuesta clínica numéricamente más rápido con mesalazina 4.5 g que 3 g o 1.5 g diarios[22]. Kamm et al[13] describieron tasas de remisión endoscópica numéricamente más altas del 78% después de 8 semanas con mesalazina MMX 4.8 g vs 2.4 g diarios (69%), pero no se informó si esto equivale a una respuesta más rápida en aquellos que logran la remisión[12,13].
Vía de administración: La mesalazina oral y tópica combinada se asoció con una resolución más rápida del sangrado rectal (media 11,9 días) que con mesalazina oral sola (25,5 días) para la colitis del lado izquierdo en el único estudio aleatorizado que informó este punto final [23]. Otro ensayo aleatorizado de sesenta pacientes con CU distal que comparó mesalazina oral con enemas de mesalazina o tratamiento combinado tópico y oral encontró una mediana de tiempo hasta la resolución del sangrado rectal de 8 días en terapia combinada y el sangrado fue significativamente menor después de diez días con terapia tópica o combinada en comparación con mesalazina oral sola. Los hallazgos indican que la terapia tópica sola o en combinación con la terapia oral logra la resolución de los síntomas más rápidamente que la terapia oral[23,24]. La eficacia del 5-ASA tópico no parece depender de la dosis en el único estudio en el que se examinó específicamente, pero no se abordó la rapidez de la respuesta[25].
CORTICOSTEROIDES
Se debe esperar una respuesta clínica a los esteroides dentro de 1 a 4 semanas de comenzar la terapia tanto para EC como para CU (no aplicable a la colitis aguda grave) con una respuesta que ocurre más rápidamente con la terapia intravenosa que con la oral [26,27]. Hay varios tipos de corticosteroides disponibles para el tratamiento de la EII y la influencia de la vía de administración y el tipo de corticosteroide son relevantes para determinar el tiempo hasta la respuesta, como se discute a continuación.
Tiempo hasta la respuesta clínica
EC: Aunque la mayoría de los pacientes con EC pueden esperar una respuesta a dosis altas de corticosteroides orales dentro de las 4 semanas, algunos datos sugieren que puede ser necesario un curso más prolongado para capturar la respuesta. Por ejemplo, la respuesta clínica después de tres a siete semanas de 1 mg/kg por día de prednisolona oral en un estudio de cohorte prospectivo de 146 pacientes con EC ileocolónica o colónica activa aumentó del 63% al 92% entre las semanas 4 y 7 respectivamente, aunque solo el 29% logró la remisión endoscópica[2]. Estos datos sugieren que un médico debe esperar hasta 7 semanas antes de decidir que una respuesta a altas dosis de prednisolona es poco probable si ese enfoque es clínicamente aceptable.
CU: La respuesta a la prednisolona oral es rápida en la CU, con un 17% -76% de remisión clínica y una mejora endoscópica del 65% -78% después de 2 semanas de prednisona oral en dos estudios aleatorizados, con las tasas de respuesta más altas observadas por Truelove et al[28] que usaron prednisolona oral y rectal en combinación[28,29]. Otros estudios también han sugerido una respuesta dentro de las primeras dos semanas de una dosis gradual de prednisolona oral que comienza en 40 mg / día en la mayoría de los pacientes con CU moderada [30].
Factores relacionados con la terapia que afectan el tiempo de respuesta
Vía de administración: (1) EC: Si bien las comparaciones directas entre los corticosteroides intravenosos y orales no están disponibles en la EC, la respuesta parece rápida con los corticosteroides intravenosos, con el 78% de los pacientes con resolución de los síntomas después de cinco días de hidrocortisona intravenosa (300 mg diarios), que aumentó al 93% después de 10 días en un estudio aleatorizado que comparó hidrocortisona intravenosa con corticotropina, a los que las tasas de respuesta también fueron altas (71% y 82% en los días 5 y 10, respectivamente)[27,31]. (2) CU: Se ha demostrado que la CU moderada generalmente mejora dentro de los cinco días de los corticosteroides intravenosos, incluidos los pacientes que no respondieron a la prednisolona oral en dosis altas.Los plazos para la respuesta esperada están bien descritos para la colitis aguda grave, donde la mayoría de los pacientes parecen responder a la terapia dentro de los 3 o 5 días de esteroides intravenosos (metilprednisolona 60 mg / día o hidrocortisona 300-400 mg / d), aunque estos son datos observacionales solo [32-35]. La falta de respuesta dentro de 5 días se asocia con una mayor tasa de colectomías posteriores nuevamente en estudios observacionales, y es poco probable que la terapia más allá de 7 días sea beneficiosa [36].
Tipo de glucocorticoide: (1) EC: Varios estudios aleatorizados han sugerido que los tiempos medios de respuesta clínica y remisión con budesonida en EC fueron comparables a los corticosteroides sistémicos, variando de 22 a 27 días [37-40].
(2) CU: La inducción de la remisión cuando se usa budesonida MMX 9 mg diarios en CU leve a moderada debe ocurrir dentro de las 4 a 8 semanas posteriores al inicio de la terapia, con 42% -47% de los pacientes logrando una mejoría endoscópica o clínica en ensayos controlados aleatorios (ECA)[41,42].
Dosis: No se ha evaluado el efecto de la dosis de corticosteroides en el tiempo de respuesta. Un estudio aleatorizado evaluó las tasas de respuesta con 20 mg, 40 mg y 60 mg diarios de prednisolona oral para el tratamiento ambulatorio de la colitis ulcerosa y sugirió una tasa de respuesta más alta tanto a las 2 semanas como a las 3-5 semanas de seguimiento con 40 y 60 mg/d de tratamiento (ambos 50% a las 2 semanas, luego 65% a las 3-5 semanas respectivamente) en comparación con 20 mg diarios (20% y luego 30%), pero no evaluó específicamente el tiempo de respuesta[30]. La determinación de la dosis apropiada de esteroide ha sido tradicionalmente empírica o basada en el peso. En consecuencia, la dosificación de corticosteroides evaluada en los ensayos clínicos ha variado; Por ejemplo, los estudios han utilizado 1 mg / kg / día o 40-60 mg / d de prednisolona, 9 mg de budesonida por vía oral, mientras que para la terapia intravenosa incluye 300-400 mg / d de hidrocortisona (dosis divididas) o 60 mg / d de metilprednisolona [26,43,44].
INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA
Las cuestiones pertinentes relacionadas con el tiempo hasta la respuesta terapéutica de la terapia anti-TNF incluyen las asociaciones con los niveles séricos del fármaco y los anticuerpos, además de la terapia concomitante.
Tiempo de respuesta
Infliximab: (1) EC: La respuesta clínica y la remisión después de la administración de infliximab parecen ser rápidas en la EC luminal, tomando 8 y 9 días respectivamente en un estudio observacional de 129 pacientes[45]. Las tasas de respuesta clínica en ECA de infliximab en EC fueron del 61% y 81% durante las semanas 2 y 4 respectivamente después de una sola infusión de infliximab [46,47]. Según los informes, las tasas de remisión clínica fueron del 88% una semana después de una dosis única de infliximab para la EC colónica, aunque los datos fueron solo observacionales[48]. Las tasas de curación de la mucosa en la enfermedad de Crohn han oscilado entre el 30% y el 67% después de 6 meses de infliximab, con tasas más altas típicamente observadas en cohortes clínicas del "mundo real" que en los ensayos[49,50].
(2) CU: La respuesta clínica y endoscópica a infliximab en pacientes con colitis ulcerosa activa crónica de moderada a grave parece tardar varias semanas, aunque esto puede deberse a la falta de notificación de los resultados tempranos después del inicio del tratamiento en el ámbito ambulatorio, dado que las tasas de respuesta informadas para la colitis aguda grave son generalmente más rápidas que esto. Sin embargo, aproximadamente la mitad de los pacientes que anteriormente no respondían a los corticosteroides intravenosos u orales experimentaron una respuesta clínica dos semanas después de la primera infusión de infliximab en un estudio prospectivo no controlado[51]. Tales tasas de respuesta temprana no se han informado en ECA, pero los datos de dichos estudios han mostrado una tasa significativamente mayor de respuesta clínica (69% vs 37%), remisión (39% vs 15%) y curación de la mucosa (62% vs 33%) en la semana 8 con dosis de inducción de 5 mg / kg versus placebo [52]. Para el uso de infliximab en la colitis ulcerosa, dos grandes estudios aleatorizados de colitis ulcerosa moderadamente grave mostraron una tasa significativamente mayor de curación de la mucosa en la semana 8 con terapia de inducción después de 5 mg / kg y 10 mg / kg (62% vs 33% con placebo) [52].
Para la colitis aguda grave, se debe esperar una respuesta clínica al tratamiento con infliximab dentro de los primeros 7 días después del tratamiento[53]. Lograr un nivel sérico más alto de infliximab durante la inducción se ha asociado con una mayor tasa de curación de la mucosa a corto plazo y un régimen de inducción acelerado de infliximab en la colitis aguda grave se ha asociado con un tiempo más prolongado hasta la colectomía que la inducción estándar, aunque la rapidez de respuesta no se ha evaluado directamente[54,55]. De hecho, datos recientes sugieren que un rebote de proteína C reactiva más alta, albúmina más baja y / o síntomas dentro de unos días después de la primera dosis de infliximab debería generar preocupaciones de falta de respuesta de infliximab y un riesgo potencialmente mayor de colectomía [55]. Actualmente se está llevando a cabo un ensayo para evaluar la utilidad de un régimen de inducción acelerada de infliximab en la colitis aguda grave y esto puede proporcionar más información sobre el efecto de la dosis y los niveles del fármaco en el tiempo de respuesta[56].
Adalimumab: (1) EC: Una respuesta inicial a adalimumab ocurre típicamente dentro de las primeras semanas de terapia, como se infiere de un ECA de fase 2 que muestra tasas de remisión clínica del 36% en la semana 4 después del tratamiento de inducción con 160/80 mg en la semana 0 y 2 para la EC, en comparación con el 12% con placebo[57]. Si bien las tasas de remisión clínica fueron más altas a partir de la semana 1 que el placebo en este estudio (16% frente a 7% respectivamente), esto solo alcanzó significación estadística en la semana 4. Además, la tasa de curación de la mucosa para la EC ileocolónica moderadamente grave con inducción de 160/80 mg de adalimumab seguida de 40 mg quincenales fue significativamente mayor que la placebo a las 12 semanas (27% frente a 13%) y se mantuvo hasta 52 semanas (24% frente a 0%) en otro ECA[58]. Las tasas de remisión endoscópica fueron del 52% y 28% en las semanas 12 y 52 respectivamente en este estudio, esta última probablemente reflejando la pérdida secundaria de respuesta durante la terapia de mantenimiento.
(2) CU: La remisión clínica y las tasas de curación de la mucosa con inducción de adalimumab con régimen de 160/80 mg en pacientes con CU moderada a grave después de 8 semanas se lograron en 19 y 47% respectivamente, con separación en las tasas de remisión clínica ya en la semana 4 en comparación con placebo en un ECA[59]. Las tasas de remisión más bajas en este estudio pueden estar relacionadas con la alta proporción (75%) de pacientes que habían fracasado en otras terapias antes de la inscripción en el estudio[59]. En otro ECA que evaluó las tasas de remisión a largo plazo con adalimumab en CU moderada a grave, las tasas de curación de la mucosa fueron del 41% en la semana 8 y del 25% en la semana 52 con adalimumab quincenal 40 mg, en comparación con el 32% y el 15% para placebo, respectivamente[60]. Las tasas de curación de la mucosa después de la inducción de adalimumab para la CU han variado entre 32% y 47% en ECA[59,60].
Certolizumab pegol: EC: Certolizumab pegol a una dosis de 400 mg administrada por vía subcutánea en las semanas 0, 2 y 4 semanas, aproximadamente un tercio de los pacientes con EC tendrán una respuesta clínica a la terapia dentro de las 2 semanas, aumentando al 41% en la semana 6 según los datos de ECA[61]. Un estudio encontró que las tasas de respuesta alcanzan un máximo de 10 semanas de terapia de 400 mg por 4 semanas[62], mientras que otro estudio encontró que las tasas de respuesta, según una reducción en CDAI de 100, alcanzaron su punto máximo en la semana 16 y disminuyeron a partir de entonces[63]. La actividad endoscópica se evaluó en la semana 10 en un ensayo clínico prospectivo y abierto de pacientes con 400 mg de certolizumab 4 veces por semana y mostró que la remisión endoscópica ocurrió en el 37%, reduciéndose al 27% en la semana 54 en EC [64].
Golimumab: CU: Golimumab se administra por vía subcutánea y ha sido aprobado para su uso en colitis ulcerosa en muchos países. Aproximadamente la mitad de los pacientes lograrán una respuesta clínica a las 6 semanas con regímenes de 100/200 mg y 400/200 mg como inducción en las semanas 0 y 2 para la colitis ulcerosa moderada a grave de un ECA grande [65]. Los datos observacionales sugieren que las tasas de respuesta pueden continuar aumentando hasta la semana 14, cuando se informa que están entre 69% y 86%[66,67]. La curación de la mucosa parece ser rápida, con 42 y 45% de los pacientes logrando la curación de la mucosa 6 semanas después de la terapia de inducción con 100/200 mg y 400/200 mg, respectivamente [65]. La terapia de inducción intravenosa para golimumab no parece conferir ningún beneficio adicional en términos de tasa de respuesta en comparación con la inyección subcutánea, aunque no se ha evaluado el tiempo de respuesta de esta estrategia[68]. Debido a que no hay datos que evalúen las tasas de respuesta clínica más allá de la semana 14, los beneficios de continuar el tratamiento más allá de este punto temporal en pacientes que no han logrado una respuesta siguen siendo inciertos.
Factores que afectan el tiempo de respuesta
Factores demográficos: Un estudio evaluó los factores basales que predijeron un logro más rápido de la remisión clínica con la terapia de inducción con certolizumab para la EC y encontró que la edad más joven, los no fumadores, la ausencia de cirugía previa de EII y una puntuación de actividad de la enfermedad más baja se asociaron con un logro más rápido de la remisión clínica [69].
Niveles de fármacos anti-TNF: Actualmente, los datos que apoyan una correlación entre los niveles de fármacos anti-TNF y el tiempo hasta la respuesta terapéutica son limitados. Para golimumab, se demostró que los niveles del fármaco en las semanas 2 y 4 se correlacionan con las tasas de respuesta clínica de la semana 6, pero el efecto sobre el tiempo hasta la respuesta terapéutica no se evaluó más a fondo ya que la respuesta solo se evaluó en un único punto temporal en este estudio[70]. Las concentraciones plasmáticas más altas de certolizumab en la semana 8 se asocian con tasas más altas de remisión clínica y remisión endoscópica en la semana 10, pero no con una tasa de respuesta clínica más alta[71]. Hay una falta de datos sobre la relación entre el tiempo hasta la respuesta de infliximab y adalimumab en relación con los niveles del fármaco.
Terapia inmunomoduladora concurrente: Si bien el tiempo hasta la respuesta no se ha comparado directamente entre la monoterapia anti-TNF y en combinación con la terapia inmunomoduladora, hubo una tendencia hacia una mayor tasa de remisión clínica en la semana 10 con la combinación de infliximab y azatioprina en comparación con infliximab solo en el Estudio de pacientes biológicos e inmunomoduladores naive en la enfermedad de Crohn (SONIC) Study, y una tasa significativamente mayor de remisión endoscópica a las 26 semanas con adalimumab y azatioprina, lo que sugiere que la terapia combinada puede funcionar más rápido que cualquiera de las terapias solas [50,72]. También se han encontrado hallazgos similares de remisión clínica más rápida para la terapia con certolizumab cuando se usa con terapia inmunomoduladora concomitante en EC[69].
VEDOLIZUMAB
Vedolizumab parece tener un tiempo de respuesta generalmente más lento en comparación con otros agentes biológicos. Esto puede estar relacionado con el mecanismo de la terapia anti-integrina, con la inhibición de la migración intestinal de linfocitos que toma más tiempo para lograr la eficacia terapéutica [73].
Tiempo de respuesta
EC: La remisión clínica con vedolizumab parece tomar al menos 10 a 14 semanas en la EC. Este inicio de acción más lento de vedolizumab, en comparación con las terapias anti-TNF, por ejemplo, fue evidente en los ensayos de registro de ECA GEMINI 2 y 3 de vedolizumab que comparan la terapia con la inducción con placebo y la terapia de mantenimiento en EC [74]. Las tasas de remisión clínica aumentaron del 15% al 27% entre las semanas 6 y 10, mientras que se mantuvieron estables en el grupo placebo (12%) en estos puntos temporales en GEMINI 3 (es decir, aquellos con fracaso anti-TNF previo), y en GEMINI 2 hubo un aumento significativo en la remisión clínica después de 6 semanas en comparación con el placebo[73]. Los datos observacionales posteriores del mundo real también han demostrado que las tasas de remisión clínica tienden a aumentar de la semana 6 a la semana 14 y en un estudio el tiempo medio hasta la respuesta clínica fue de 19 semanas[75]. Las tasas de curación de la mucosa del 30% se alcanzaron después de una mediana de 22 semanas en EC en un estudio observacional [76]. Además, GEMINI 2 encontró que casi el 40% de los respondedores iniciales a vedolizumab permanecieron en remisión clínica a 52 semanas, aunque las tasas de remisión clínica solo se volvieron superiores al placebo después de 30 semanas[77].
CU: Las tasas de respuesta y remisión parecen más rápidas en la CU que en la EC. En la semana 6 después de una inducción de 2 dosis, la respuesta clínica, las tasas de remisión y la curación de la mucosa fueron significativamente mayores con vedolizumab que con placebo (47%, 17% y 41% frente a 26%, 5% y 25% respectivamente) en un ECA[78]. Además, el vedolizumab de mantenimiento dio lugar a tasas más altas de remisión clínica y endoscópica en la semana 52 que en la semana 6 y las puntuaciones parciales medias de Mayo continuaron disminuyendo hasta la semana 52, lo que sugiere que la respuesta máxima a menudo tarda varios meses.
Factores relacionados con la terapia que afectan el tiempo de respuesta
Si bien los inmunomoduladores parecen reducir la formación de anticuerpos anti fármacos contra vedolizumab[78], la baja proporción de pacientes que realmente formaron anticuerpos anti fármacos en los ensayos podría implicar que la terapia combinada puede ser innecesaria y, por lo tanto, puede no proporcionar un beneficio adicional al tiempo de respuesta terapéutica, en contraste con las terapias anti-TNF[78].
TIOPURINAS
Las tiopurinas, incluyendo azatioprina y 6-mercaptopurina, parecen ejercer su efecto a través de los metabolitos, nucleótidos de 6-tioguanina (6-TGN). Las tiopurinas inhiben la síntesis de ADN, ARN y proteínas que conducen a la inhibición de la proliferación de linfocitos y la apoptosis, por lo tanto, la inmunosupresión[79].
Tiempo de respuesta
CD: La azatioprina o mercaptopurina toman al menos 4 a 8 semanas para lograr la remisión clínica[80]. Un ECA pequeño sugirió que se requería una mediana de 10,7 semanas para lograr la remisión clínica con azatioprina oral 2 mg/kg/d[81]. El tiempo hasta la respuesta clínica con 1,5 mg/kg/día de mercaptopurina se evaluó en un ECA por Present et al[82] en pacientes con corticosteroides o sulfasalazina que fallan en la EC. Demostraron un amplio tiempo de respuesta terapéutica de dos semanas a nueve meses con una mediana de 3,1 meses; El 19% de los casos tardaron más de 4 meses en lograr una respuesta clínica sostenida[82]. Del mismo modo, en otro ECA, Ardizzone et al[83] encontraron un aumento de la tasa de remisión clínica del 33% al 63% de 3 a 6 meses después de iniciar la azatioprina 2 mg/kg/día en pacientes con EC dependiente de corticosteroides. Las tasas de remisión endoscópica también parecen ser lentas para lograr, ya que solo el 17% de los pacientes tratados con azatioprina en el estudio SONIC lograron la curación de la mucosa después de 26 semanas de terapia[50]. Otro ECA que comparó budesonida con azatioprina con un seguimiento de 1 año encontró que la curación de la mucosa ocurrió con tiopurinas en el 83% de la EC dependiente de esteroides a los 12 meses, lo que implica que la mejoría endoscópica continúa acumulándose lentamente durante períodos prolongados [84].
CU: Tanto la respuesta clínica como la endoscópica a las tiopurinas en la CU parecen tomar un mínimo de un mes, pero más típicamente 3-6 meses para la CU dependiente de esteroides [85,86]. Ardizzone et al[87] encontraron que más de la mitad de los pacientes con azatioprina estaban en remisión endoscópica y clínica libre de esteroides después de 6 meses para los pacientes con CU dependiente de esteroides, que fue significativamente mayor que con mesalazina (53% vs 21%) en un ECA. Otro ECA mostró una disminución significativa en una puntuación de actividad de la enfermedad compuesta (incluidos los hallazgos endoscópicos, clínicos y bioquímicos) a los 3 y 6 meses después de comenzar azatioprina 2.5 mg / kg / día para la CU dependiente de esteroides, lo que implica que el tiempo hasta la respuesta terapéutica es probable entre 3 y 6 meses [88].
Factores que afectan el tiempo de respuesta
Niveles de metabolitos: La azatioprina experimenta una rápida conversión no enzimática a 6-mercaptopurina que luego se metaboliza a 6-TGN en eritrocitos y leucocitos [89]. El efecto terapéutico de las tiopurinas parece proporcional a las concentraciones de 6-TGN, con un estado estacionario alcanzado de dos a cuatro semanas, por lo que la respuesta solo puede esperarse después de este período[90]. La carga intravenosa con azatioprina se ha asociado con un tiempo más rápido para la respuesta terapéutica inicialmente (1 semana para la respuesta clínica y 4 semanas para la mejoría endoscópica). Sin embargo, en comparación con la azatioprina oral a las 8 semanas, no hubo diferencias en las tasas de remisión o los niveles de 6-TGN habían persistido [80,91]. Utilizando la titulación de la dosis guiada por la monitorización terapéutica del fármaco, el tiempo medio hasta la respuesta terapéutica disminuyó de 22 a 19 semanas[92]. Si bien los estudios prospectivos no han demostrado una diferencia en los resultados entre los pacientes tratados con tiopurinas basadas en el peso y las dosis individualizadas y guiadas por metabolitos [93,94], los datos retrospectivos sólidos aclararon tasas más altas de remisión clínica con niveles de 6-TGN superiores a 230-260 pmol/8 × 108 glóbulos rojos[95-97]. De hecho, el 78%-90% de los pacientes habían mejorado los resultados clínicos de la optimización de la dosis después de tener un nivel subterapéutico de 6-TGN [98-100].
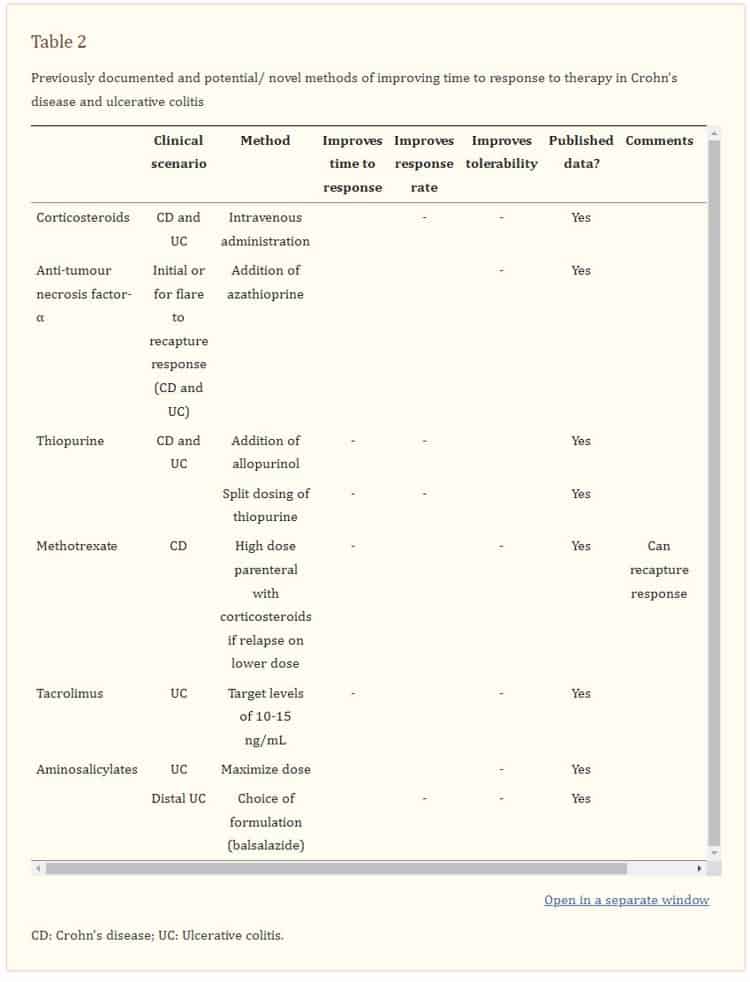
Adición de alopurinol: Se ha utilizado una combinación de alopurinol 100 mg y 25% -50% de la dosis estándar de tiopurina para superar una serie de efectos secundarios relacionados con la tiopurina y corregir un perfil de metabolitos desfavorable (los llamados hipermetiladores), con alta eficacia clínica [101-105]. Esto ha despertado interés en cuanto a si la terapia combinada alopurinol-tiopurina podría lograr no solo tasas más altas, sino también un tiempo más rápido para la respuesta terapéutica, especialmente en comparación con los protocolos de dosificación introductoria de ajuste lento (según lo recomendado por las pautas de tratamiento [26,106] y ampliamente utilizado para mitigar los efectos secundarios tempranos [107]). Se espera el resultado de los ensayos controlados que abordan esta cuestión[108]. Las estrategias adicionales que pueden afectar el tiempo de respuesta de las terapias se resumen en la Tabla 22.
METOTREXATO
El metotrexato es un análogo del ácido fólico utilizado en el tratamiento de múltiples afecciones autoinmunes, incluida la EII. El metotrexato ha demostrado ser eficaz como terapia de inducción y mantenimiento en la EC, particularmente cuando se administra por vía parenteral. El papel del metotrexato en la CU es menos claro, aunque un ensayo controlado con placebo de metotrexato subcutáneo sugirió eficacia clínica en la inducción de la remisión libre de esteroides [109].
Tiempo de respuesta
EC: Se debe esperar una respuesta clínica dentro de las 12 semanas con metotrexato administrado por vía parenteral de acuerdo con un ensayo abierto, no aleatorizado de Kozarek et al[110]. Un estudio observacional sugirió que la mediana del tiempo de respuesta clínica fue de 9 semanas para la terapia oral y parenteral (aunque el 86% estaba en terapia parenteral en este estudio) y la remisión clínica tomó 22 semanas [111]. A pesar de que la mayoría de los pacientes responden clínicamente dentro de las primeras semanas de terapia, un subgrupo puede tardar hasta 6 meses en responder[83].
CU: Mientras que un ensayo controlado con placebo de metotrexato oral 12,5 mg en pacientes con CU refractaria a esteroides no mostró diferencias significativas en la remisión clínica entre los grupos, aquellos que alcanzaron la remisión clínica con metotrexato tomaron una media de 4,1 meses para hacerlo [112]. Las observaciones no controladas posteriores de Kozarek et al[110] mostraron una respuesta clínica rápida (71% dentro de las 12 semanas) con dosis intramusculares de dosis altas en CU, aunque solo en 7 pacientes. El ECA METEOR, evaluó la eficacia del metotrexato parenteral 25 mg semanales en CU dependiente de esteroides y encontró que casi un tercio de los pacientes tenían remisión clínica sin corticosteroides en la semana 16, que aumentó al 40% en la semana 24 [109]. La remisión endoscópica se logró en una proporción numéricamente mayor que el grupo placebo, pero la diferencia no alcanzó significación estadística, tal vez debido a la falta de poder estadístico.
Factores que afectan el tiempo de respuesta
Vía de administración: Es probable que el metotrexato parenteral generalmente logre un tiempo de respuesta terapéutica más rápido en una mayor proporción de pacientes debido a una mayor biodisponibilidad, aunque la evidencia de apoyo solo se encuentra en la literatura reumatológica[113].
Niveles de fármacos: Actualmente no existe un método fiable para aplicar la monitorización farmacológica terapéutica del metotrexato en la atención rutinaria de la EII y, por lo tanto, esto no es útil para predecir el tiempo hasta la respuesta terapéutica. Los niveles séricos de metotrexato solo son detectables durante aproximadamente 24 h después de la dosis y parecen no correlacionarse con la respuesta clínica en la EII [114], los niveles de adenosina no se correlacionan con la eficacia [115] y los poliglutamatos de metotrexato [metabolitos activos del metotrexato] han mostrado resultados inconsistentes [116-118]. Finalmente, aunque el ácido fólico es un complemento importante para el uso de metotrexato y puede reducir el malestar gastrointestinal y la disfunción hepática, no tiene un impacto aparente en el tiempo de respuesta terapéutica [119].
INHIBIDORES DE LA CALCINEURINA
Tacrolimus y ciclosporina son inhibidores de la calcineurina con evidencia en la EII principalmente para la CU resistente a los esteroides. Pequeñas series de casos han sugerido la eficacia de tacrolimus para la inducción de la remisión en la EC luminal[120]. La ciclosporina es una terapia de rescate eficaz en la colitis aguda grave y se ha utilizado en la CU crónica moderada a grave. La ciclosporina oral no parece ser una terapia de inducción efectiva en la EC[121].
Tiempo de respuesta
Tacrolimus: (1) CU: Cuando se dirige a un nivel mínimo de 10-15 ng / ml, tacrolimus induce una respuesta clínica y tasas de curación de la mucosa de 50% -68% y 44% -79% respectivamente, en pacientes con CU dentro de 2 semanas según los resultados de dos ECA, con tasas más bajas observadas en el mayor de estos estudios [122,123]. En contraste, la remisión clínica se informó en solo 9% -20% después de 2 semanas en los estudios antes mencionados, pero entre aquellos que continuaron con tacrolimus, las tasas de remisión aumentaron al 29% en la semana 12, con tasas de curación de la mucosa aumentando de 67% a 86% durante el mismo período de tiempo [122,123]. (2) EC: Las series de casos pequeños sugieren una respuesta clínica igualmente rápida con tacrolimus en EC refractaria a otras terapias, que ocurre dentro de 30-40 días [124,125]. Sin embargo, el tiempo hasta la respuesta terapéutica parece más largo que la CU, con un estudio que encontró que el 36% logró la remisión clínica a los 20 días, que aumentó al 64% a los 120 días [125].
Ciclosporina: CU: La respuesta clínica a la ciclosporina en la colitis aguda grave que no responde a los corticosteroides intravenosos suele ser rápida, con una mediana de tiempo de respuesta reportada de 4-5 días, y la gran mayoría respondió dentro de los 7 días en dos estudios aleatorizados [53,126]. Las tasas de remisión clínica fueron de aproximadamente 65% con ciclosporina en monoterapia y 93% en combinación con esteroides después de 7 días, según los resultados de un estudio aleatorizado de D'Haens et al[127] En los estudios anteriores, la respuesta endoscópica se describió dentro de los 7 días del inicio, con una mejora continua en la actividad endoscópica observada entre las semanas 1 y 4 [126,127].
Factores que afectan el tiempo de respuesta
Dosis y niveles del fármaco: Dirigirse a niveles altos (10-15 ng / ml) de tacrolimus para la inducción parece más efectivo que los niveles bajos (5-10 ng / ml) con posiblemente un tiempo más rápido para la respuesta terapéutica [123]. Para el mantenimiento continuo a partir de entonces, apuntar a niveles mínimos de 5-10 ng / ml parece suficiente [122-125].
Para la ciclosporina, no se logró ningún beneficio adicional en la respuesta clínica con 4 mg / kg en comparación con 2 mg / kg por vía intravenosa en un ECA para la colitis aguda grave con una mediana de tiempo hasta la respuesta de 4 días en ambos grupos, lo que sugiere que las dosis superiores a 2 mg / kg no producen un tiempo de respuesta más rápido [126].
Vía de administración: Un estudio observacional sugirió que el tacrolimus oral e intravenoso logró tasas similares de respuesta clínica en 14 días en la colitis refractaria a esteroides, con niveles séricos comparables de tacrolimus alcanzados con ambas estrategias[128]. Un estudio retrospectivo de ciclosporina oral e intravenosa en colitis ulcerosa encontró una mayor tasa de respuesta clínica temprana (momento exacto no especificado) con ciclosporina oral en comparación con intravenosa (100% vs 65%) a pesar de niveles séricos comparables de fármacos, principalmente debido a tasas más altas de efectos secundarios que requieren el cese del tratamiento con ciclosporina intravenosa [129]. El tiempo hasta la respuesta no se evaluó directamente en este estudio y los grupos difirieron significativamente con mayores proporciones de pacientes hospitalizados y fracasos de corticosteroides intravenosos en el grupo de ciclosporina intravenosa.
NUTRICIÓN ENTERAL EXCLUSIVA
La nutrición enteral exclusiva (NEE) implica la administración de una fórmula nutricional líquida para satisfacer todos los requisitos nutricionales, reemplazando la dieta normal, ya sea por vía oral o por sonda nasoentérica. Se utiliza principalmente para la inducción de la remisión en CD típicamente durante una duración de 6-8 semanas. Si bien la mayoría de los datos provienen de estudios pediátricos, la eficacia también es probable en adultos[130].
El tiempo de respuesta con NEE parece rápido, con el 75% de los pacientes adultos con EC activa logrando la remisión clínica después de 10 días de una alimentación elemental en un ECA pequeño [131]. Otros ECA pequeños han demostrado tasas de remisión clínica del 25% al 80% dentro de las 3-4 semanas posteriores al inicio [132-138]. En dos estudios de cohortes no aleatorizados que utilizaron criterios de valoración objetivos de actividad de la enfermedad, el 44% de los pacientes lograron la curación de la mucosa después de 4 semanas de NEE y, en una cohorte pediátrica, el 36% tuvo curación de la mucosa después de 8 semanas de NEE [139,140].
FACTORES ADICIONALES QUE AFECTAN EL TIEMPO HASTA LA RESPUESTA CLÍNICA
Factores relacionados con la enfermedad
Hay varios factores relacionados con el paciente y la enfermedad que parecen importantes a la hora de predecir la probabilidad de respuesta y el tiempo hasta la respuesta terapéutica en pacientes individuales (véase el cuadro 3).3). Los agentes tienden a lograr un tiempo de respuesta terapéutica más rápido en la CU que en la EC. Esto puede relacionarse con la naturaleza transmural de la EC, por lo que el tratamiento lleva más tiempo para lograr la resolución de los cambios inflamatorios. Esta diferencia en el tiempo de respuesta terapéutica se ejemplifica en los estudios de registro de vedolizumab, donde la terapia de inducción pareció tener tasas de respuesta más altas en la CU que en la EC y los beneficios en la EC se observaron predominantemente más tarde durante la fase de mantenimiento [73,78].
Los pacientes que no han logrado una respuesta adecuada a las terapias previas pueden tener una respuesta más lenta a las terapias posteriores. Esto se observó con la inducción de vedolizumab, donde los fracasos previos anti-TNF lograron tasas de remisión clínica que solo se volvieron significativamente diferentes al placebo después de 10 semanas, en contraste con la cohorte general donde las tasas de remisión clínica fueron más altas en la semana 6 en comparación con el placebo[74]. Se encontraron hallazgos similares de un tiempo más largo hasta la remisión clínica en pacientes que habían recibido infliximab previamente y posteriormente fueron tratados con certolizumab por inducción para EC[69].
Factores relacionados con el paciente
Si bien varios factores adicionales intuitivamente podrían afectar el tiempo de respuesta terapéutica, como el estado nutricional, la edad y el microbioma intestinal, faltan datos publicados. La edad avanzada se asocia típicamente con una tasa de filtración glomerular reducida, mayor estrés oxidativo, mayor volumen de distribución, afecciones comórbidas, disminución del metabolismo hepático y fragilidad, cualquiera de los cuales puede afectar la elección del tratamiento y el tiempo de respuesta clínica de una terapia [141,142]. Por ejemplo, un estudio retrospectivo encontró que las tasas de respuesta clínica a la terapia anti-TNF para la EII en pacientes > 65 años fueron significativamente menores en la semana 10, pero no significativamente diferentes a los 6 meses que los controles emparejados con comorbilidades similares de < 65 años, lo que sugiere un inicio más lento de la respuesta en general[143]. La limitada evidencia disponible también sugiere que la obesidad puede afectar la tasa de respuesta, aunque no se ha estudiado el efecto sobre el tiempo hasta la respuesta. Por ejemplo, un mayor peso basal se asoció con una menor tasa de remisión clínica después de la terapia de inducción con adalimumab en el estudio ULTRA-1 y se ha asociado con una pérdida más temprana de respuesta a infliximab y adalimumab en la EII [59,144,145].
Aunque muchos de estos factores no son modificables, la intervención temprana en el curso de la enfermedad y / o medidas complementarias simples, como mejorar la nutrición, puede permitir un tiempo más rápido para la respuesta terapéutica.
DISCUSIÓN
Esta revisión ha dilucidado múltiples principios importantes del tiempo hasta la respuesta terapéutica con aplicabilidad directa a la práctica clínica. En primer lugar, la paciencia es fundamental (tanto para los pacientes como para los médicos) para obtener los máximos beneficios de algunos agentes, en particular las tiopurinas, el vedolizumab y el metotrexato, con ganancias acumuladas en respuesta a estos agentes hasta 12 meses después del comienzo. De hecho, los beneficios clínicos podrían retrasarse significativamente más allá de que el medicamento alcance los niveles terapéuticos. Por ejemplo, esto se reflejó en un estudio que evaluó si la carga intravenosa inicial de azatioprina podría acelerar el tiempo de respuesta. De hecho, los niveles terapéuticos de 6-TGN se alcanzaron rápidamente. Sin embargo, esto no mejoró el tiempo hasta la respuesta terapéutica en comparación con la administración oral estándar[80]. Por lo tanto, la evaluación de la respuesta debe retrasarse hasta que haya transcurrido el tiempo suficiente para alcanzar la eficacia clínica. Si bien la mejoría sintomática puede ocurrir relativamente temprano después del inicio de muchas terapias, a menudo parece haber un retraso en el logro de la cicatrización de la mucosa, que debe considerarse al interpretar una evaluación endoscópica temprana. Este concepto se demostró en un ensayo controlado aleatorio por Sutherland et al[146] que comparó enemas de aminosalicilato de 4 g con enemas placebo para el tratamiento de la CU distal. Las tasas de respuesta clínica y la endoscopia se midieron a las 3 y 6 semanas, con tasas de respuesta que alcanzaron el 60% en la semana 3 en el brazo de aminosalicilatos, luego se estabilizaron para alcanzar el 68% en la semana 6. Las tasas de curación de la mucosa durante el mismo período aumentaron del 25% al 42%, lo que sugiere un aumento posterior[24]. Además, los pacientes mantuvieron un diario de síntomas durante las primeras dos semanas de este ensayo y el sangrado rectal había cesado en más de la mitad de los pacientes para el día 6, por lo que la mejoría de los síntomas puede haber ocurrido más rápidamente que el momento de la medición del resultado. Por lo tanto, puede ser apropiado retrasar la evaluación hasta después de que haya pasado el tiempo esperado para la respuesta terapéutica.
En segundo lugar, se deduce que un período prolongado de terapia puente, como la administración concomitante de EEN, corticosteroides o incluso quizás tacrolimus, es un componente importante de la planificación del tratamiento, particularmente en pacientes que se encuentran gravemente enfermos, de modo que se evite la recaída si es posible, antes de la respuesta máxima esperada de una terapia recién introducida. En tercer lugar, en agentes en los que es más probable un retraso en el tiempo hasta la respuesta terapéutica, se debe considerar si se pueden emplear métodos potenciales para acelerar el inicio de la acción, como la tiopurina y el alopurinol en combinación o tal vez el uso de EEN en combinación con un agente anti-TNF en la EC como terapia de inducción.
Significativamente, la falta de informes sobre el tiempo de respuesta en los ensayos clínicos es una deficiencia. En su mayoría, los datos deben extrapolarse de los estudios en lugar de informarse directamente. Dada su utilidad en la práctica clínica y los cálculos relativamente básicos requeridos, esto debe abordarse en estudios futuros. El tiempo de respuesta esperado puede ayudar potencialmente en el diseño del ensayo al proporcionar una estimación de la duración necesaria de un estudio para mostrar la máxima eficacia. Por ejemplo, para vedolizumab para el tratamiento de la EC, la tasa de respuesta de CDAI-100 no fue significativa en la semana 6 y solo superó al placebo alrededor de la semana 28[73]. Del mismo modo, también se observaron tasas de respuesta temprana modestas con otra terapia anti-integrina natalizumab en la semana 10 con tasas de respuesta que aumentaron durante la terapia de mantenimiento[147]. El uso de la semana 6 en lugar de la semana 10 o posterior como los tiempos de respuesta para vedolizumab ha sido una crítica de los grandes estudios aleatorizados[77]. Por lo tanto, dicha información puede ser potencialmente reportada en estudios tempranos y, por lo tanto, proporcionar una mayor comprensión de la rapidez de acción de los fármacos o, más ampliamente, las clases de fármacos, que pueden incorporarse en futuros estudios de esa terapia, además de en la práctica clínica.
Finalmente, el concepto de tiempo hasta la respuesta es un término amplio y es probable que se pueda dividir aún más en función de la proporción de pacientes que han respondido a la terapia, como se muestra en la Tabla 1.1. Hay un punto de tiempo en el que la mayoría de los pacientes responderán y luego de esto hay rendimientos progresivamente decrecientes en la probabilidad de una respuesta adicional, que culmina en un punto donde la respuesta es poco probable; el tiempo de la futilidad. Este concepto sigue siendo clínicamente importante, ya que el rendimiento de persistir con la terapia más allá de este punto es bajo y, por lo tanto, coloca a los pacientes en mayor riesgo, con un beneficio mínimo o nulo. Una vez más, dicha información se incluya idealmente en los datos publicados para ayudar mejor a los médicos con las decisiones terapéuticas.
CONCLUSIÓN
En una enfermedad crónica como la EII, donde muchas terapias son efectivas pero de inicio de acción relativamente lento, el tiempo de respuesta terapéutica es de importancia central tanto cuantitativamente para enmarcar las expectativas del paciente y la toma de decisiones del médico, como también fomentando conceptualmente la mentalidad de planificación anticipada del tratamiento, superposición de terapias puente y precisión en la determinación del fracaso terapéutico. Además, en contraste con el informe homogeneizado y grupal de los resultados de los ECA seminales como el estándar de referencia para cada nuevo agente, el tiempo hasta la respuesta terapéutica es inherentemente centrado en el paciente e individualizado. Esto no solo se debe a que tiene el potencial de variar según la indicación, la dosis, los factores demográficos y clínicos y depende del punto final que se elija (es decir, respuesta clínica, remisión o remisión endoscópica), sino que se puede argumentar que el tiempo hasta la respuesta terapéutica es de mucha mayor relevancia para los pacientes y quizás incluso para los médicos en la práctica diaria. Por lo tanto, los estudios futuros deberían examinar e incorporar más este paradigma.
Referencias
1. Markowitz J. Early inflammatory bowel disease: different treatment response to specific or all medications? Dig Dis. 2009;27:358–365. [PubMed] [Google Scholar]
2. Modigliani R, Mary JY, Simon JF, Cortot A, Soule JC, Gendre JP, Rene E. Clinical, biological, and endoscopic picture of attacks of Crohn’s disease. Evolution on prednisolone. Groupe d’Etude Thérapeutique des Affections Inflammatoires Digestives. Gastroenterology. 1990;98:811–818. [PubMed] [Google Scholar]
3. Cellier C, Sahmoud T, Froguel E, Adenis A, Belaiche J, Bretagne JF, Florent C, Bouvry M, Mary JY, Modigliani R. Correlations between clinical activity, endoscopic severity, and biological parameters in colonic or ileocolonic Crohn’s disease. A prospective multicentre study of 121 cases. The Groupe d’Etudes Thérapeutiques des Affections Inflammatoires Digestives. Gut. 1994;35:231–235. [PMC free article] [PubMed] [Google Scholar]
4. Peyrin-Biroulet L, Reinisch W, Colombel JF, Mantzaris GJ, Kornbluth A, Diamond R, Rutgeerts P, Tang LK, Cornillie FJ, Sandborn WJ. Clinical disease activity, C-reactive protein normalisation and mucosal healing in Crohn’s disease in the SONIC trial. Gut. 2014;63:88–95. [PubMed] [Google Scholar]
5. Jharap B, Sandborn WJ, Reinisch W, D’Haens G, Robinson AM, Wang W, Huang B, Lazar A, Thakkar RB, Colombel JF. Randomised clinical study: discrepancies between patient-reported outcomes and endoscopic appearance in moderate to severe ulcerative colitis. Aliment Pharmacol Ther. 2015;42:1082–1092. [PMC free article] [PubMed] [Google Scholar]
6. Kiss LS, Szamosi T, Molnar T, Miheller P, Lakatos L, Vincze A, Palatka K, Barta Z, Gasztonyi B, Salamon A, et al. Early clinical remission and normalisation of CRP are the strongest predictors of efficacy, mucosal healing and dose escalation during the first year of adalimumab therapy in Crohn’s disease. Aliment Pharmacol Ther. 2011;34:911–922. [PubMed] [Google Scholar]
7. Turner D, Griffiths AM, Veerman G, Johanns J, Damaraju L, Blank M, Hyams J. Endoscopic and clinical variables that predict sustained remission in children with ulcerative colitis treated with infliximab. Clin Gastroenterol Hepatol. 2013;11:1460–1465. [PubMed] [Google Scholar]
8. Peyrin-Biroulet L, Panés J, Sandborn WJ, Vermeire S, Danese S, Feagan BG, Colombel JF, Hanauer SB, Rycroft B. Defining Disease Severity in Inflammatory Bowel Diseases: Current and Future Directions. Clin Gastroenterol Hepatol. 2016;14:348–354.e17. [PubMed] [Google Scholar]
9. Wang Y, Parker CE, Bhanji T, Feagan BG, MacDonald JK. Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev. 2016;4:CD000543. [PMC free article] [PubMed] [Google Scholar]
10. Ford AC, Kane SV, Khan KJ, Achkar JP, Talley NJ, Marshall JK, Moayyedi P. Efficacy of 5-aminosalicylates in Crohn’s disease: systematic review and meta-analysis. Am J Gastroenterol. 2011;106:617–629. [PubMed] [Google Scholar]
11. Lim WC, Wang Y, MacDonald JK, Hanauer S. Aminosalicylates for induction of remission or response in Crohn’s disease. Cochrane Database Syst Rev. 2016;7:CD008870. [PMC free article] [PubMed] [Google Scholar]
12. Miglioli MB, Brunetti G. Delayed release mesalazine in the treatment of mild ulcerative colitis: a dose ranging study. Eur J Gastroenterol Hepatol. 1990;2:229–234. [Google Scholar]
13. Kamm MA, Sandborn WJ, Gassull M, Schreiber S, Jackowski L, Butler T, Lyne A, Stephenson D, Palmen M, Joseph RE. Once-daily, high-concentration MMX mesalamine in active ulcerative colitis. Gastroenterology. 2007;132:66–75; quiz 432-433. [PubMed] [Google Scholar]
14. Baron JH, Connell AM, Lennard-jones JE, Jones FA. Sulphasalazine and salicylazosulphadimidine in ulcerative colitis. Lancet. 1962;1:1094–1096. [PubMed] [Google Scholar]
15. Lennard-Jones JE, Longmore AJ, Newell AC, Wilson CW, Jones FA. An assessment of prednisone, salazopyrin, and topical hydrocortisone hemisuccinate used as out-patient treatment for ulcerative colitis. Gut. 1960;1:217–222. [PMC free article] [PubMed] [Google Scholar]
16. Selby WS, Barr GD, Ireland A, Mason CH, Jewell DP. Olsalazine in active ulcerative colitis. Br Med J (Clin Res Ed) 1985;291:1373–1375. [PMC free article] [PubMed] [Google Scholar]
17. Green JR, Lobo AJ, Holdsworth CD, Leicester RJ, Gibson JA, Kerr GD, Hodgson HJ, Parkins KJ, Taylor MD. Balsalazide is more effective and better tolerated than mesalamine in the treatment of acute ulcerative colitis. The Abacus Investigator Group. Gastroenterology. 1998;114:15–22. [PubMed] [Google Scholar]
18. Oliva-Hemker M, Hutfless S, Al Kazzi ES, Lerer T, Mack D, LeLeiko N, Griffiths A, Cabrera J, Otley A, Rick J, et al. Clinical Presentation and Five-Year Therapeutic Management of Very Early-Onset Inflammatory Bowel Disease in a Large North American Cohort. J Pediatr. 2015;167:527–532.e1-3. [PubMed] [Google Scholar]
19. Riley SA, Mani V, Goodman MJ, Herd ME, Dutt S, Turnberg LA. Comparison of delayed-release 5-aminosalicylic acid (mesalazine) and sulfasalazine as maintenance treatment for patients with ulcerative colitis. Gastroenterology. 1988;94:1383–1389. [PubMed] [Google Scholar]
20. Levine DS, Riff DS, Pruitt R, Wruble L, Koval G, Sales D, Bell JK, Johnson LK. A randomized, double blind, dose-response comparison of balsalazide (6.75 g), balsalazide (2.25 g), and mesalamine (2.4 g) in the treatment of active, mild-to-moderate ulcerative colitis. Am J Gastroenterol. 2002;97:1398–1407. [PubMed] [Google Scholar]
21. Orchard TR, van der Geest SA, Travis SP. Randomised clinical trial: early assessment after 2 weeks of high-dose mesalazine for moderately active ulcerative colitis-new light on a familiar question. Aliment Pharmacol Ther. 2011;33:1028–1035. [PubMed] [Google Scholar]
22. Kruis W, Bar-Meir S, Feher J, Mickisch O, Mlitz H, Faszczyk M, Chowers Y, Lengyele G, Kovacs A, Lakatos L, et al. The optimal dose of 5-aminosalicylic acid in active ulcerative colitis: a dose-finding study with newly developed mesalamine. Clin Gastroenterol Hepatol. 2003;1:36–43. [PubMed] [Google Scholar]
23. Safdi M, DeMicco M, Sninsky C, Banks P, Wruble L, Deren J, Koval G, Nichols T, Targan S, Fleishman C, et al. A double-blind comparison of oral versus rectal mesalamine versus combination therapy in the treatment of distal ulcerative colitis. Am J Gastroenterol. 1997;92:1867–1871. [PubMed] [Google Scholar]24. Sandborn WJ, Hanauer S, Lichtenstein GR, Safdi M, Edeline M, Scott Harris M. Early symptomatic response and mucosal healing with mesalazine rectal suspension therapy in active distal ulcerative colitis--additional results from two controlled studies. Aliment Pharmacol Ther. 2011;34:747–756. [PubMed] [Google Scholar]
25. Hanauer SB. Dose-ranging study of mesalamine (PENTASA) enemas in the treatment of acute ulcerative proctosigmoiditis: results of a multicentered placebo-controlled trial. The U.S. PENTASA Enema Study Group. Inflamm Bowel Dis. 1998;4:79–83. [PubMed] [Google Scholar]
26. Lichtenstein GR, Abreu MT, Cohen R, Tremaine W; American Gastroenterological Association. American Gastroenterological Association Institute technical review on corticosteroids, immunomodulators, and infliximab in inflammatory bowel disease. Gastroenterology. 2006;130:940–987. [PubMed] [Google Scholar]
27. Shepherd HA, Barr GD, Jewell DP. Use of an intravenous steroid regimen in the treatment of acute Crohn’s disease. J Clin Gastroenterol. 1986;8:154–159. [PubMed] [Google Scholar]
28. Truelove SC, Watkinson G, Draper G. Comparison of corticosteroid and sulphasalazine therapy in ulcerative colitis. Br Med J. 1962;2:1708–1711. [PMC free article] [PubMed] [Google Scholar]
29. Hawthorne AB, Record CO, Holdsworth CD, Giaffer MH, Burke DA, Keech ML, Hawkey CJ. Double blind trial of oral fluticasone propionate v prednisolone in the treatment of active ulcerative colitis. Gut. 1993;34:125–128. [PMC free article] [PubMed] [Google Scholar]
30. Baron JH, Connell AM, Kanaghinis TG, Lennard-Jones JE, Jones AF. Out-patient treatment of ulcerative colitis. Comparison between three doses of oral prednisone. Br Med J. 1962;2:441–443. [PMC free article] [PubMed] [Google Scholar]
31. Chun A, Chadi RM, Korelitz BI, Colonna T, Felder JB, Jackson MH, Morgenstern EH, Rubin SD, Sacknoff AG, Gleim GM. Intravenous corticotrophin vs. hydrocortisone in the treatment of hospitalized patients with Crohn’s disease: a randomized double-blind study and follow-up. Inflamm Bowel Dis. 1998;4:177–181. [PubMed] [Google Scholar]
32. Truelove SC, Jewell DP. Intensive intravenous regimen for severe attacks of ulcerative colitis. Lancet. 1974;1:1067–1070. [PubMed] [Google Scholar]
33. Truelove SC, Willoughby CP, Lee EG, Kettlewell MG. Further experience in the treatment of severe attacks of ulcerative colitis. Lancet. 1978;2:1086–1088. [PubMed] [Google Scholar]
34. Järnerot G, Rolny P, Sandberg-Gertzén H. Intensive intravenous treatment of ulcerative colitis. Gastroenterology. 1985;89:1005–1013. [PubMed] [Google Scholar]
35. Travis SP, Farrant JM, Ricketts C, Nolan DJ, Mortensen NM, Kettlewell MG, Jewell DP. Predicting outcome in severe ulcerative colitis. Gut. 1996;38:905–910. [PMC free article] [PubMed] [Google Scholar]
36. Molnár T, Farkas K, Nyári T, Szepes Z, Nagy F, Wittmann T. Response to first intravenous steroid therapy determines the subsequent risk of colectomy in ulcerative colitis patients. J Gastrointestin Liver Dis. 2011;20:359–363. [PubMed] [Google Scholar]
37. Tremaine WJ, Hanauer SB, Katz S, Winston BD, Levine JG, Persson T, Persson A; Budesonide CIR United States Study Group. Budesonide CIR capsules (once or twice daily divided-dose) in active Crohn’s disease: a randomized placebo-controlled study in the United States. Am J Gastroenterol. 2002;97:1748–1754. [PubMed] [Google Scholar]
38. Gross V, Andus T, Caesar I, Bischoff SC, Lochs H, Tromm A, Schulz HJ, Bär U, Weber A, Gierend M, et al. Oral pH-modified release budesonide versus 6-methylprednisolone in active Crohn’s disease. German/Austrian Budesonide Study Group. Eur J Gastroenterol Hepatol. 1996;8:905–909. [PubMed] [Google Scholar]
39. Tursi A, Giorgetti GM, Brandimarte G, Elisei W, Aiello F. Beclomethasone dipropionate for the treatment of mild-to-moderate Crohn’s disease: an open-label, budesonide-controlled, randomized study. Med Sci Monit. 2006;12:PI29–PI32. [PubMed] [Google Scholar]
40. Thomsen OO, Cortot A, Jewell D, Wright JP, Winter T, Veloso FT, Vatn M, Persson T, Pettersson E. A comparison of budesonide and mesalamine for active Crohn’s disease. International Budesonide-Mesalamine Study Group. N Engl J Med. 1998;339:370–374. [PubMed] [Google Scholar]
41. Sandborn WJ, Travis S, Moro L, Jones R, Gautille T, Bagin R, Huang M, Yeung P, Ballard ED 2nd. Once-daily budesonide MMX® extended-release tablets induce remission in patients with mild to moderate ulcerative colitis: results from the CORE I study. Gastroenterology. 2012;143:1218–1226.e1-2. [PubMed] [Google Scholar]
42. D'Haens GR, Kovács A, Vergauwe P, Nagy F, Molnár T, Bouhnik Y, Weiss W, Brunner H, Lavergne-Slove A, Binelli D, et al. Clinical trial: Preliminary efficacy and safety study of a new Budesonide-MMX® 9 mg extended-release tablets in patients with active left-sided ulcerative colitis. J Crohns Colitis. 2010;4:153–160. [PubMed] [Google Scholar]
43. Carter MJ, Lobo AJ, Travis SP; IBD Section, British Society of Gastroenterology. Guidelines for the management of inflammatory bowel disease in adults. Gut. 2004;53 Suppl 5:V1–V16. [PMC free article] [PubMed] [Google Scholar]
44. Dignass A, Lindsay JO, Sturm A, Windsor A, Colombel JF, Allez M, D’Haens G, D’Hoore A, Mantzaris G, Novacek G, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis. 2012;6:991–1030. [PubMed] [Google Scholar]
45. Cohen RD, Tsang JF, Hanauer SB. Infliximab in Crohn’s disease: first anniversary clinical experience. Am J Gastroenterol. 2000;95:3469–3477. [PubMed] [Google Scholar]
46. Targan SR, Hanauer SB, van Deventer SJ, Mayer L, Present DH, Braakman T, DeWoody KL, Schaible TF, Rutgeerts PJ. A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor alpha for Crohn’s disease. Crohn’s Disease cA2 Study Group. N Engl J Med. 1997;337:1029–1035. [PubMed] [Google Scholar]
47. Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet. 2002;359:1541–1549. [PubMed] [Google Scholar]
48. Nikolaus S, Raedler A, Kühbacker T, Sfikas N, Fölsch UR, Schreiber S. Mechanisms in failure of infliximab for Crohn’s disease. Lancet. 2000;356:1475–1479. [PubMed] [Google Scholar]
49. Tursi A, Elisei W, Giorgetti GM, Penna A, Picchio M, Brandimarte G. factors influencing mucosal healing in Crohn’s disease during infliximab treatment. Hepatogastroenterology. 2013;60:1041–1046. [PubMed] [Google Scholar]
50. Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, Lichtiger S, D’Haens G, Diamond RH, Broussard DL, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med. 2010;362:1383–1395. [PubMed] [Google Scholar]
51. Sands BE, Tremaine WJ, Sandborn WJ, Rutgeerts PJ, Hanauer SB, Mayer L, Targan SR, Podolsky DK. Infliximab in the treatment of severe, steroid-refractory ulcerative colitis: a pilot study. Inflamm Bowel Dis. 2001;7:83–88. [PubMed] [Google Scholar]
52. Rutgeerts P, Sandborn WJ, Feagan BG, Reinisch W, Olson A, Johanns J, Travers S, Rachmilewitz D, Hanauer SB, Lichtenstein GR, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med. 2005;353:2462–2476. [PubMed] [Google Scholar]53. Laharie D, Bourreille A, Branche J, Allez M, Bouhnik Y, Filippi J, Zerbib F, Savoye G, Nachury M, Moreau J, et al. Ciclosporin versus infliximab in patients with severe ulcerative colitis refractory to intravenous steroids: a parallel, open-label randomised controlled trial. Lancet. 2012;380:1909–1915. [PubMed] [Google Scholar]
54. Papamichael K, Van Stappen T, Vande Casteele N, Gils A, Billiet T, Tops S, Claes K, Van Assche G, Rutgeerts P, Vermeire S, et al. Infliximab Concentration Thresholds During Induction Therapy Are Associated With Short-term Mucosal Healing in Patients With Ulcerative Colitis. Clin Gastroenterol Hepatol. 2016;14:543–549. [PubMed] [Google Scholar]
55. Gibson DJ, Heetun ZS, Redmond CE, Nanda KS, Keegan D, Byrne K, Mulcahy HE, Cullen G, Doherty GA. An accelerated infliximab induction regimen reduces the need for early colectomy in patients with acute severe ulcerative colitis. Clin Gastroenterol Hepatol. 2015;13:330–335.e1. [PubMed] [Google Scholar]
56. Austin Health. Optimising Infliximab Induction Therapy for Acute Severe Ulcerative Colitis (PREDICT-UC). Bethesda (MD): National Library of Medicine (US). Cited 2016-12-20. Available from: https://clinicaltrials.gov/show/NCT02770040.
57. Hanauer SB, Sandborn WJ, Rutgeerts P, Fedorak RN, Lukas M, MacIntosh D, Panaccione R, Wolf D, Pollack P. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s disease: the CLASSIC-I trial. Gastroenterology. 2006;130:323–333; quiz 591. [PubMed] [Google Scholar]
58. Rutgeerts P, Van Assche G, Sandborn WJ, Wolf DC, Geboes K, Colombel JF, Reinisch W; EXTEND Investigators, Kumar A, Lazar A, Camez A, Lomax KG, Pollack PF, D’Haens G. Adalimumab induces and maintains mucosal healing in patients with Crohn’s disease: data from the EXTEND trial. Gastroenterology. 2012;142:1102–1111.e2. [PubMed] [Google Scholar]
59. Reinisch W, Sandborn WJ, Hommes DW, D’Haens G, Hanauer S, Schreiber S, Panaccione R, Fedorak RN, Tighe MB, Huang B, et al. Adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomised controlled trial. Gut. 2011;60:780–787. [PubMed] [Google Scholar]
60. Sandborn WJ, van Assche G, Reinisch W, Colombel JF, D’Haens G, Wolf DC, Kron M, Tighe MB, Lazar A, Thakkar RB. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology. 2012;142:257–265.e1-e3. [PubMed] [Google Scholar]
61. Sandborn WJ, Schreiber S, Feagan BG, Rutgeerts P, Younes ZH, Bloomfield R, Coteur G, Guzman JP, D’Haens GR. Certolizumab pegol for active Crohn’s disease: a placebo-controlled, randomized trial. Clin Gastroenterol Hepatol. 2011;9:670–678.e3. [PubMed] [Google Scholar]
62. Schreiber S, Rutgeerts P, Fedorak RN, Khaliq-Kareemi M, Kamm MA, Boivin M, Bernstein CN, Staun M, Thomsen OØ, Innes A; CDP870 Crohn’s Disease Study Group. A randomized, placebo-controlled trial of certolizumab pegol (CDP870) for treatment of Crohn’s disease. Gastroenterology. 2005;129:807–818. [PubMed] [Google Scholar]
63. Sandborn WJ, Feagan BG, Stoinov S, Honiball PJ, Rutgeerts P, Mason D, Bloomfield R, Schreiber S; PRECISE 1 Study Investigators. Certolizumab pegol for the treatment of Crohn’s disease. N Engl J Med. 2007;357:228–238. [PubMed] [Google Scholar]
64. Hébuterne X, Lémann M, Bouhnik Y, Dewit O, Dupas JL, Mross M, D’Haens G, Mitchev K, Ernault É, Vermeire S, Brixi-Benmansour H, Moreels TG, Mary JY, Marteau P, Colombel JF. Endoscopic improvement of mucosal lesions in patients with moderate to severe ileocolonic Crohn’s disease following treatment with certolizumab pegol. Gut. 2013;62:201–208. [PMC free article] [PubMed] [Google Scholar]
65. Sandborn WJ, Feagan BG, Marano C, Zhang H, Strauss R, Johanns J, Adedokun OJ, Guzzo C, Colombel JF, Reinisch W, et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology. 2014;146:85–95; quiz e14-15. [PubMed] [Google Scholar]
66. Bosca-Watts MM, Cortes X, Iborra M, Huguet JM, Sempere L, Garcia G, Gil R, Garcia M, Muñoz M, Almela P, et al. Short-term effectiveness of golimumab for ulcerative colitis: Observational multicenter study. World J Gastroenterol. 2016;22:10432–10439. [PMC free article] [PubMed] [Google Scholar]
67. Castro-Laria L, Argüelles-Arias F, García-Sánchez V, Benítez JM, Fernández-Pérez R, Trapero-Fernández AM, Gallardo-Sánchez F, Pallarés-Manrique H, Gómez-García M, Cabello-Tapia MJ, et al. Initial experience with golimumab in clinical practice for ulcerative colitis. Rev Esp Enferm Dig. 2016;108:129–132. [PubMed] [Google Scholar]
68. Rutgeerts P, Feagan BG, Marano CW, Padgett L, Strauss R, Johanns J, Adedokun OJ, Guzzo C, Zhang H, Colombel JF, et al. Randomised clinical trial: a placebo-controlled study of intravenous golimumab induction therapy for ulcerative colitis. Aliment Pharmacol Ther. 2015;42:504–514. [PMC free article] [PubMed] [Google Scholar]
69. Sandborn WJ, Melmed GY, McGovern DP, Loftus EV Jr, Choi JM, Cho JH, Abraham B, Gutierrez A, Lichtenstein G, Lee SD, Randall CW, Schwartz DA, Regueiro M, Siegel CA, Spearman M, Kosutic G, Pierre-Louis B, Coarse J, Schreiber S. Clinical and demographic characteristics predictive of treatment outcomes for certolizumab pegol in moderate to severe Crohn’s disease: analyses from the 7-year PRECiSE 3 study. Aliment Pharmacol Ther. 2015;42:330–342. [PubMed] [Google Scholar]
70. Adedokun OJ, Xu Z, Marano CW, Strauss R, Zhang H, Johanns J, Zhou H, Davis HM, Reinisch W, Feagan BG, et al. Pharmacokinetics and Exposure-response Relationship of Golimumab in Patients with Moderately-to-Severely Active Ulcerative Colitis: Results from Phase 2/3 PURSUIT Induction and Maintenance Studies. J Crohns Colitis. 2017;11:35–46. [PMC free article] [PubMed] [Google Scholar]
71. Colombel JF, Sandborn WJ, Allez M, Dupas JL, Dewit O, D’Haens G, Bouhnik Y, Parker G, Pierre-Louis B, Hébuterne X. Association between plasma concentrations of certolizumab pegol and endoscopic outcomes of patients with Crohn’s disease. Clin Gastroenterol Hepatol. 2014;12:423–431.e1. [PubMed] [Google Scholar]
72. Matsumoto T, Motoya S, Watanabe K, Hisamatsu T, Nakase H, Yoshimura N, Ishida T, Kato S, Nakagawa T, Esaki M, et al. 854 Comparison of Adalimumab Monotherapy and a Combination With Azathioprine for Patients With Crohn’s Disease: A Prospective, Multicenter, Open-Labeled Clinical Trial (DIAMOND Study) Gastroenterology. 2016;150:S182. [Google Scholar]
73. Sandborn WJ, Feagan BG, Rutgeerts P, Hanauer S, Colombel JF, Sands BE, Lukas M, Fedorak RN, Lee S, Bressler B, et al. Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med. 2013;369:711–721. [PubMed] [Google Scholar]
74. Sands BE, Feagan BG, Rutgeerts P, Colombel JF, Sandborn WJ, Sy R, D’Haens G, Ben-Horin S, Xu J, Rosario M, et al. Effects of vedolizumab induction therapy for patients with Crohn’s disease in whom tumor necrosis factor antagonist treatment failed. Gastroenterology. 2014;147:618–627.e3. [PubMed] [Google Scholar]75. Dulai PS, Singh S, Jiang X, Peerani F, Narula N, Chaudrey K, Whitehead D, Hudesman D, Lukin D, Swaminath A, et al. The Real-World Effectiveness and Safety of Vedolizumab for Moderate-Severe Crohn’s Disease: Results From the US VICTORY Consortium. Am J Gastroenterol. 2016;111:1147–1155. [PubMed] [Google Scholar]
76. Vivio EE, Kanuri N, Gilbertsen JJ, Monroe K, Dey N, Chen CH, Gutierrez AM, Ciorba MA. Vedolizumab Effectiveness and Safety Over the First Year of Use in an IBD Clinical Practice. J Crohns Colitis. 2016;10:402–409. [PMC free article] [PubMed] [Google Scholar]77. Bryant RV, Sandborn WJ, Travis SP. Introducing vedolizumab to clinical practice: who, when, and how? J Crohns Colitis. 2015;9:356–366. [PubMed] [Google Scholar]
78. Feagan BG, Rutgeerts P, Sands BE, Hanauer S, Colombel JF, Sandborn WJ, Van Assche G, Axler J, Kim HJ, Danese S, et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med. 2013;369:699–710. [PubMed] [Google Scholar]
79. Moon W, Loftus EV Jr. Review article: recent advances in pharmacogenetics and pharmacokinetics for safe and effective thiopurine therapy in inflammatory bowel disease. Aliment Pharmacol Ther. 2016;43:863–883. [PubMed] [Google Scholar]
80. Sandborn WJ, Tremaine WJ, Wolf DC, Targan SR, Sninsky CA, Sutherland LR, Hanauer SB, McDonald JW, Feagan BG, Fedorak RN, et al. Lack of effect of intravenous administration on time to respond to azathioprine for steroid-treated Crohn’s disease. North American Azathioprine Study Group. Gastroenterology. 1999;117:527–535. [PubMed] [Google Scholar]
81. Willoughby JM, Beckett J, Kumar PJ, Dawson AM. Controlled trial of azathioprine in Crohn’s disease. Lancet. 1971;2:944–947. [PubMed] [Google Scholar]
82. Present DH, Korelitz BI, Wisch N, Glass JL, Sachar DB, Pasternack BS. Treatment of Crohn’s disease with 6-mercaptopurine. A long-term, randomized, double-blind study. N Engl J Med. 1980;302:981–987. [PubMed] [Google Scholar]
83. Ardizzone S, Bollani S, Manzionna G, Imbesi V, Colombo E, Bianchi Porro G. Comparison between methotrexate and azathioprine in the treatment of chronic active Crohn’s disease: a randomised, investigator-blind study. Dig Liver Dis. 2003;35:619–627. [PubMed] [Google Scholar]
84. Mantzaris GJ, Christidou A, Sfakianakis M, Roussos A, Koilakou S, Petraki K, Polyzou P. Azathioprine is superior to budesonide in achieving and maintaining mucosal healing and histologic remission in steroid-dependent Crohn’s disease. Inflamm Bowel Dis. 2009;15:375–382. [PubMed] [Google Scholar]
85. Kirk AP, Lennard-Jones JE. Controlled trial of azathioprine in chronic ulcerative colitis. Br Med J (Clin Res Ed) 1982;284:1291–1292. [PMC free article] [PubMed] [Google Scholar]
86. Jewell DP, Truelove SC. Azathioprine in ulcerative colitis: final report on controlled therapeutic trial. Br Med J. 1974;4:627–630. [PMC free article] [PubMed] [Google Scholar]
87. Ardizzone S, Maconi G, Russo A, Imbesi V, Colombo E, Bianchi Porro G. Randomised controlled trial of azathioprine and 5-aminosalicylic acid for treatment of steroid dependent ulcerative colitis. Gut. 2006;55:47–53. [PMC free article] [PubMed] [Google Scholar]
88. Rosenberg JL, Wall AJ, Levin B, Binder HJ, Kirsner JB. A controlled trial of azathioprine in the management of chronic ulcerative colitis. Gastroenterology. 1975;69:96–99. [PubMed] [Google Scholar]
89. Teml A, Schaeffeler E, Herrlinger KR, Klotz U, Schwab M. Thiopurine treatment in inflammatory bowel disease: clinical pharmacology and implication of pharmacogenetically guided dosing. Clin Pharmacokinet. 2007;46:187–208. [PubMed] [Google Scholar]
90. Sandborn WJ. Rational dosing of azathioprine and 6-mercaptopurine. Gut. 2001;48:591–592. [PMC free article] [PubMed] [Google Scholar]
91. Sandborn WJ, Van O EC, Zins BJ, Tremaine WJ, Mays DC, Lipsky JJ. An intravenous loading dose of azathioprine decreases the time to response in patients with Crohn’s disease. Gastroenterology. 1995;109:1808–1817. [PubMed] [Google Scholar]
92. Dubinsky MC, Reyes E, Ofman J, Chiou CF, Wade S, Sandborn WJ. A cost-effectiveness analysis of alternative disease management strategies in patients with Crohn’s disease treated with azathioprine or 6-mercaptopurine. Am J Gastroenterol. 2005;100:2239–2247. [PubMed] [Google Scholar]
93. Reinshagen M, Schütz E, Armstrong VW, Behrens C, von Tirpitz C, Stallmach A, Herfarth H, Stein J, Bias P, Adler G, et al. 6-thioguanine nucleotide-adapted azathioprine therapy does not lead to higher remission rates than standard therapy in chronic active crohn disease: results from a randomized, controlled, open trial. Clin Chem. 2007;53:1306–1314. [PubMed] [Google Scholar]
94. Dassopoulos T, Dubinsky MC, Bentsen JL, Martin CF, Galanko JA, Seidman EG, Sandler RS, Hanauer SB. Randomised clinical trial: individualised vs. weight-based dosing of azathioprine in Crohn’s disease. Aliment Pharmacol Ther. 2014;39:163–175. [PMC free article] [PubMed] [Google Scholar]
95. Moreau AC, Paul S, Del Tedesco E, Rinaudo-Gaujous M, Boukhadra N, Genin C, Peyrin-Biroulet L, Roblin X. Association between 6-thioguanine nucleotides levels and clinical remission in inflammatory disease: a meta-analysis. Inflamm Bowel Dis. 2014;20:464–471. [PubMed] [Google Scholar]
96. Dubinsky MC, Lamothe S, Yang HY, Targan SR, Sinnett D, Théorêt Y, Seidman EG. Pharmacogenomics and metabolite measurement for 6-mercaptopurine therapy in inflammatory bowel disease. Gastroenterology. 2000;118:705–713. [PubMed] [Google Scholar]
97. Cuffari C, Hunt S, Bayless T. Utilisation of erythrocyte 6-thioguanine metabolite levels to optimise azathioprine therapy in patients with inflammatory bowel disease. Gut. 2001;48:642–646. [PMC free article] [PubMed] [Google Scholar]
98. Haines ML, Ajlouni Y, Irving PM, Sparrow MP, Rose R, Gearry RB, Gibson PR. Clinical usefulness of therapeutic drug monitoring of thiopurines in patients with inadequately controlled inflammatory bowel disease. Inflamm Bowel Dis. 2011;17:1301–1307. [PubMed] [Google Scholar]
99. Kennedy NA, Asser TL, Mountifield RE, Doogue MP, Andrews JM, Bampton PA. Thiopurine metabolite measurement leads to changes in management of inflammatory bowel disease. Intern Med J. 2013;43:278–286. [PubMed] [Google Scholar]
100. Smith M, Blaker P, Patel C, Marinaki A, Arenas M, Escuredo E, Anderson S, Irving P, Sanderson J. The impact of introducing thioguanine nucleotide monitoring into an inflammatory bowel disease clinic. Int J Clin Pract. 2013;67:161–169. [PubMed] [Google Scholar]
101. Sparrow MP, Hande SA, Friedman S, Lim WC, Reddy SI, Cao D, Hanauer SB. Allopurinol safely and effectively optimizes tioguanine metabolites in inflammatory bowel disease patients not responding to azathioprine and mercaptopurine. Aliment Pharmacol Ther. 2005;22:441–446. [PubMed] [Google Scholar]
102. Rahhal RM, Bishop WP. Initial clinical experience with allopurinol-thiopurine combination therapy in pediatric inflammatory bowel disease. Inflamm Bowel Dis. 2008;14:1678–1682. [PubMed] [Google Scholar]103. Leung Y, Sparrow MP, Schwartz M, Hanauer SB. Long term efficacy and safety of allopurinol and azathioprine or 6-mercaptopurine in patients with inflammatory bowel disease. J Crohns Colitis. 2009;3:162–167. [PubMed] [Google Scholar]
104. Ansari A, Patel N, Sanderson J, O’Donohue J, Duley JA, Florin TH. Low-dose azathioprine or mercaptopurine in combination with allopurinol can bypass many adverse drug reactions in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2010;31:640–647. [PubMed] [Google Scholar]
105. Pavlidis P, Stamoulos P, Abdulrehman A, Kerr P, Bull C, Duley J, Ansari A. Long-term Safety and Efficacy of Low-dose Azathioprine and Allopurinol Cotherapy in Inflammatory Bowel Disease: A Large Observational Study. Inflamm Bowel Dis. 2016;22:1639–1646. [PubMed] [Google Scholar]
106. Lee KM, Kim YS, Seo GS, Kim TO, Yang SK; IBD Study Group of the Korean Association for the Study of Intestinal Diseases. Use of Thiopurines in Inflammatory Bowel Disease: A Consensus Statement by the Korean Association for the Study of Intestinal Diseases (KASID) Intest Res. 2015;13:193–207. [PMC free article] [PubMed] [Google Scholar]
107. Yip JS, Woodward M, Abreu MT, Sparrow MP. How are Azathioprine and 6-mercaptopurine dosed by gastroenterologists? Results of a survey of clinical practice. Inflamm Bowel Dis. 2008;14:514–518. [PubMed] [Google Scholar]
108. Kiszka-Kanowitz M, Theede K, Mertz-Nielsen A. Randomized clinical trial: a pilot study comparing efficacy of low-dose azathioprine and allopurinol to azathioprine on clinical outcomes in inflammatory bowel disease. Scand J Gastroenterol. 2016;51:1470–1475. [PubMed] [Google Scholar]
109. Carbonnel F, Colombel JF, Filippi J, Katsanos KH, Peyrin-Biroulet L, Allez M, Nachury M, Novacek G, Danese S, Abitbol V, et al. Methotrexate Is Not Superior to Placebo for Inducing Steroid-Free Remission, but Induces Steroid-Free Clinical Remission in a Larger Proportion of Patients With Ulcerative Colitis. Gastroenterology. 2016;150:380–388.e4. [PubMed] [Google Scholar]
110. Kozarek RA, Patterson DJ, Gelfand MD, Botoman VA, Ball TJ, Wilske KR. Methotrexate induces clinical and histologic remission in patients with refractory inflammatory bowel disease. Ann Intern Med. 1989;110:353–356. [PubMed] [Google Scholar]
111. Chong RY, Hanauer SB, Cohen RD. Efficacy of parenteral methotrexate in refractory Crohn’s disease. Aliment Pharmacol Ther. 2001;15:35–44. [PubMed] [Google Scholar]
112. Oren R, Arber N, Odes S, Moshkowitz M, Keter D, Pomeranz I, Ron Y, Reisfeld I, Broide E, Lavy A, et al. Methotrexate in chronic active ulcerative colitis: a double-blind, randomized, Israeli multicenter trial. Gastroenterology. 1996;110:1416–1421. [PubMed] [Google Scholar]
113. Islam MS, Haq SA, Islam MN, Azad AK, Islam MA, Barua R, Hasan MM, Mahmood M, Safiuddin M, Rahman MM, et al. Comparative efficacy of subcutaneous versus oral methotrexate in active rheumatoid arthritis. Mymensingh Med J. 2013;22:483–488. [PubMed] [Google Scholar]
114. Egan LJ, Sandborn WJ, Tremaine WJ, Leighton JA, Mays DC, Pike MG, Zinsmeister AR, Lipsky JJ. A randomized dose-response and pharmacokinetic study of methotrexate for refractory inflammatory Crohn’s disease and ulcerative colitis. Aliment Pharmacol Ther. 1999;13:1597–1604. [PubMed] [Google Scholar]
115. Egan LJ, Sandborn WJ, Mays DC, Tremaine WJ, Lipsky JJ. Plasma and rectal adenosine in inflammatory bowel disease: effect of methotrexate. Inflamm Bowel Dis. 1999;5:167–173. [PubMed] [Google Scholar]
116. Dervieux T, Furst D, Lein DO, Capps R, Smith K, Walsh M, Kremer J. Polyglutamation of methotrexate with common polymorphisms in reduced folate carrier, aminoimidazole carboxamide ribonucleotide transformylase, and thymidylate synthase are associated with methotrexate effects in rheumatoid arthritis. Arthritis Rheum. 2004;50:2766–2774. [PubMed] [Google Scholar]
117. Fischer M, Siva S, Cook GK, Jones DR, Fadda HM. Methotrexate Polyglutamate Monitoring in Patients With Crohn’s Disease. Clin Pharmacol Drug Dev. 2017;6:240–245. [PubMed] [Google Scholar]
118. Brooks AJ, Begg EJ, Zhang M, Frampton CM, Barclay ML. Red blood cell methotrexate polyglutamate concentrations in inflammatory bowel disease. Ther Drug Monit. 2007;29:619–625. [PubMed] [Google Scholar]
119. Shea B, Swinden MV, Ghogomu ET, Ortiz Z, Katchamart W, Rader T, Bombardier C, Wells GA, Tugwell P. Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for rheumatoid arthritis. J Rheumatol. 2014;41:1049–1060. [PubMed] [Google Scholar]
120. McSharry K, Dalzell AM, Leiper K, El-Matary W. Systematic review: the role of tacrolimus in the management of Crohn’s disease. Aliment Pharmacol Ther. 2011;34:1282–1294. [PubMed] [Google Scholar]
121. McDonald JW, Feagan BG, Jewell D, Brynskov J, Stange EF, Macdonald JK. Cyclosporine for induction of remission in Crohn’s disease. Cochrane Database Syst Rev. 2005;(2):CD000297. [PubMed] [Google Scholar]
122. Ogata H, Kato J, Hirai F, Hida N, Matsui T, Matsumoto T, Koyanagi K, Hibi T. Double-blind, placebo-controlled trial of oral tacrolimus (FK506) in the management of hospitalized patients with steroid-refractory ulcerative colitis. Inflamm Bowel Dis. 2012;18:803–808. [PubMed] [Google Scholar]
123. Ogata H, Matsui T, Nakamura M, Iida M, Takazoe M, Suzuki Y, Hibi T. A randomised dose finding study of oral tacrolimus (FK506) therapy in refractory ulcerative colitis. Gut. 2006;55:1255–1262. [PMC free article] [PubMed] [Google Scholar]
124. Baumgart DC, Pintoffl JP, Sturm A, Wiedenmann B, Dignass AU. Tacrolimus is safe and effective in patients with severe steroid-refractory or steroid-dependent inflammatory bowel disease--a long-term follow-up. Am J Gastroenterol. 2006;101:1048–1056. [PubMed] [Google Scholar]
125. Tamaki H, Nakase H, Matsuura M, Inoue S, Mikami S, Ueno S, Uza N, Kitamura H, Kasahara K, Chiba T. The effect of tacrolimus (FK-506) on Japanese patients with refractory Crohn’s disease. J Gastroenterol. 2008;43:774–779. [PubMed] [Google Scholar]
126. Van Assche G, D’Haens G, Noman M, Vermeire S, Hiele M, Asnong K, Arts J, D’Hoore A, Penninckx F, Rutgeerts P. Randomized, double-blind comparison of 4 mg/kg versus 2 mg/kg intravenous cyclosporine in severe ulcerative colitis. Gastroenterology. 2003;125:1025–1031. [PubMed] [Google Scholar]
127. D'Haens G, Lemmens L, Geboes K, Vandeputte L, Van Acker F, Mortelmans L, Peeters M, Vermeire S, Penninckx F, Nevens F, et al. Intravenous cyclosporine versus intravenous corticosteroids as single therapy for severe attacks of ulcerative colitis. Gastroenterology. 2001;120:1323–1329. [PubMed] [Google Scholar]
128. Fellermann K, Tanko Z, Herrlinger KR, Witthoeft T, Homann N, Bruening A, Ludwig D, Stange EF. Response of refractory colitis to intravenous or oral tacrolimus (FK506) Inflamm Bowel Dis. 2002;8:317–324. [PubMed] [Google Scholar]129. Actis GC, Aimo G, Priolo G, Moscato D, Rizzetto M, Pagni R. Efficacy and efficiency of oral microemulsion cyclosporin versus intravenous and soft gelatin capsule cyclosporin in the treatment of severe steroid-refractory ulcerative colitis: an open-label retrospective trial. Inflamm Bowel Dis. 1998;4:276–279. [PubMed] [Google Scholar]
130. Wall CL, Day AS, Gearry RB. Use of exclusive enteral nutrition in adults with Crohn’s disease: a review. World J Gastroenterol. 2013;19:7652–7660. [PMC free article] [PubMed] [Google Scholar]
131. Giaffer MH, North G, Holdsworth CD. Controlled trial of polymeric versus elemental diet in treatment of active Crohn’s disease. Lancet. 1990;335:816–819. [PubMed] [Google Scholar]
132. Gassull MA, Fernández-Bañares F, Cabré E, Papo M, Giaffer MH, Sánchez-Lombraña JL, Richart C, Malchow H, González-Huix F, Esteve M; Eurpoean Group on Enteral Nutrition in Crohn’s Disease. Fat composition may be a clue to explain the primary therapeutic effect of enteral nutrition in Crohn’s disease: results of a double blind randomised multicentre European trial. Gut. 2002;51:164–168. [PMC free article] [PubMed] [Google Scholar]
133. Bamba T, Shimoyama T, Sasaki M, Tsujikawa T, Fukuda Y, Koganei K, Hibi T, Iwao Y, Munakata A, Fukuda S, et al. Dietary fat attenuates the benefits of an elemental diet in active Crohn’s disease: a randomized, controlled trial. Eur J Gastroenterol Hepatol. 2003;15:151–157. [PubMed] [Google Scholar]
134. Mansfield JC, Giaffer MH, Holdsworth CD. Controlled trial of oligopeptide versus amino acid diet in treatment of active Crohn’s disease. Gut. 1995;36:60–66. [PMC free article] [PubMed] [Google Scholar]
135. Verma S, Brown S, Kirkwood B, Giaffer MH. Polymeric versus elemental diet as primary treatment in active Crohn’s disease: a randomized, double-blind trial. Am J Gastroenterol. 2000;95:735–739. [PubMed] [Google Scholar]
136. Rigaud D, Cosnes J, Le Quintrec Y, René E, Gendre JP, Mignon M. Controlled trial comparing two types of enteral nutrition in treatment of active Crohn’s disease: elemental versus polymeric diet. Gut. 1991;32:1492–1497. [PMC free article] [PubMed] [Google Scholar]
137. Middleton SJ, Rucker JT, Kirby GA, Riordan AM, Hunter JO. Long-chain triglycerides reduce the efficacy of enteral feeds in patients with active Crohn’s disease. Clin Nutr. 1995;14:229–236. [PubMed] [Google Scholar]
138. González-Huix F, de León R, Fernández-Bañares F, Esteve M, Cabré E, Acero D, Abad-Lacruz A, Figa M, Guilera M, Planas R. Polymeric enteral diets as primary treatment of active Crohn’s disease: a prospective steroid controlled trial. Gut. 1993;34:778–782. [PMC free article] [PubMed] [Google Scholar]
139. Yamamoto T, Nakahigashi M, Umegae S, Kitagawa T, Matsumoto K. Impact of elemental diet on mucosal inflammation in patients with active Crohn’s disease: cytokine production and endoscopic and histological findings. Inflamm Bowel Dis. 2005;11:580–588. [PubMed] [Google Scholar]
140. Fell JM, Paintin M, Arnaud-Battandier F, Beattie RM, Hollis A, Kitching P, Donnet-Hughes A, MacDonald TT, Walker-Smith JA. Mucosal healing and a fall in mucosal pro-inflammatory cytokine mRNA induced by a specific oral polymeric diet in paediatric Crohn’s disease. Aliment Pharmacol Ther. 2000;14:281–289. [PubMed] [Google Scholar]
141. Juneja M, Schwartz M, El Mourabet M, Regueiro M, Harrison J, Barrie AM, Swoger JM, Baidoo L, Saul MI, Binion DG. W1276 W1276 Patterns of Medical Treatment and Polypharmacy in Geriatric Crohn’s Disease. Gastroenterology. 2010;138:S–689. [Google Scholar]
142. Katz S, Pardi DS. Inflammatory bowel disease of the elderly: frequently asked questions (FAQs) Am J Gastroenterol. 2011;106:1889–1897. [PubMed] [Google Scholar]
143. Lobatón T, Ferrante M, Rutgeerts P, Ballet V, Van Assche G, Vermeire S. Efficacy and safety of anti-TNF therapy in elderly patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2015;42:441–451. [PubMed] [Google Scholar]
144. Harper JW, Sinanan MN, Zisman TL. Increased body mass index is associated with earlier time to loss of response to infliximab in patients with inflammatory bowel disease. Inflamm Bowel Dis. 2013;19:2118–2124. [PubMed] [Google Scholar]
145. Bultman E, de Haar C, van Liere-Baron A, Verhoog H, West RL, Kuipers EJ, Zelinkova Z, van der Woude CJ. Predictors of dose escalation of adalimumab in a prospective cohort of Crohn’s disease patients. Aliment Pharmacol Ther. 2012;35:335–341. [PubMed] [Google Scholar]
146. Sutherland LR, Martin F, Greer S, Robinson M, Greenberger N, Saibil F, Martin T, Sparr J, Prokipchuk E, Borgen L. 5-Aminosalicylic acid enema in the treatment of distal ulcerative colitis, proctosigmoiditis, and proctitis. Gastroenterology. 1987;92:1894–1898. [PubMed] [Google Scholar]
147. Sandborn WJ, Colombel JF, Enns R, Feagan BG, Hanauer SB, Lawrance IC, Panaccione R, Sanders M, Schreiber S, Targan S, van Deventer S, Goldblum R, Despain D, Hogge GS, Rutgeerts P; International Efficacy of Natalizumab as Active Crohn’s Therapy (ENACT-1) Trial Group; Evaluation of Natalizumab as Continuous Therapy (ENACT-2) Trial Group. Natalizumab induction and maintenance therapy for Crohn’s disease. N Engl J Med. 2005;353:1912–1925. [PubMed] [Google Scholar]
148. Sninsky CA, Cort DH, Shanahan F, Powers BJ, Sessions JT, Pruitt RE, Jacobs WH, Lo SK, Targan SR, Cerda JJ. Oral mesalamine (Asacol) for mildly to moderately active ulcerative colitis. A multicenter study. Ann Intern Med. 1991;115:350–355. [PubMed] [Google Scholar]
149. Colombel JF, Rutgeerts P, Reinisch W, Esser D, Wang Y, Lang Y, Marano CW, Strauss R, Oddens BJ, Feagan BG, et al. Early mucosal healing with infliximab is associated with improved long-term clinical outcomes in ulcerative colitis. Gastroenterology. 2011;141:1194–1201. [PubMed] [Google Scholar]
150. Llaó J, Naves JE, Ruiz-Cerulla A, Marín L, Mañosa M, Rodríguez-Alonso L, Cabré E, Garcia-Planella E, Guardiola J, Domènech E. Intravenous corticosteroids in moderately active ulcerative colitis refractory to oral corticosteroids. J Crohns Colitis. 2014;8:1523–1528. [PubMed] [Google Scholar]
151. Shih DQ, Nguyen M, Zheng L, Ibanez P, Mei L, Kwan LY, Bradford K, Ting C, Targan SR, Vasiliauskas EA. Split-dose administration of thiopurine drugs: a novel and effective strategy for managing preferential 6-MMP metabolism. Aliment Pharmacol Ther. 2012;36:449–458. [PubMed] [Google Scholar]
152. Feagan BG, Fedorak RN, Irvine EJ, Wild G, Sutherland L, Steinhart AH, Greenberg GR, Koval J, Wong CJ, Hopkins M, et al. A comparison of methotrexate with placebo for the maintenance of remission in Crohn’s disease. North American Crohn’s Study Group Investigators. N Engl J Med. 2000;342:1627–1632. [PubMed] [Google Scholar]
153. Holtmann MH, Krummenauer F, Claas C, Kremeyer K, Lorenz D, Rainer O, Vogel I, Böcker U, Böhm S, Büning C, et al. Significant differences between Crohn’s disease and ulcerative colitis regarding the impact of body mass index and initial disease activity on responsiveness to azathioprine: results from a European multicenter study in 1,176 patients. Dig Dis Sci. 2010;55:1066–1078. [PubMed] [Google Scholar]
154. Arnott ID, McNeill G, Satsangi J. An analysis of factors influencing short-term and sustained response to infliximab treatment for Crohn’s disease. Aliment Pharmacol Ther. 2003;17:1451–1457. [PubMed] [Google Scholar]
155. Colombel JF, Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Panaccione R, Schreiber S, Byczkowski D, Li J, Kent JD, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn’s disease: the CHARM trial. Gastroenterology. 2007;132:52–65. [PubMed] [Google Scholar]
156. Schreiber S, Colombel JF, Bloomfield R, Nikolaus S, Schölmerich J, Panés J, Sandborn WJ; PRECiSE 2 Study Investigators. Increased response and remission rates in short-duration Crohn’s disease with subcutaneous certolizumab pegol: an analysis of PRECiSE 2 randomized maintenance trial data. Am J Gastroenterol. 2010;105:1574–1582. [PubMed] [Google Scholar]
157. D'Haens G, Baert F, van Assche G, Caenepeel P, Vergauwe P, Tuynman H, De Vos M, van Deventer S, Stitt L, Donner A, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn’s disease: an open randomised trial. Lancet. 2008;371:660–667. [PubMed] [Google Scholar]