El perfil de seguridad de upadacitinib concurrió con estudios de dermatitis atópica previos, sin observarse riesgos de seguridad nuevo.
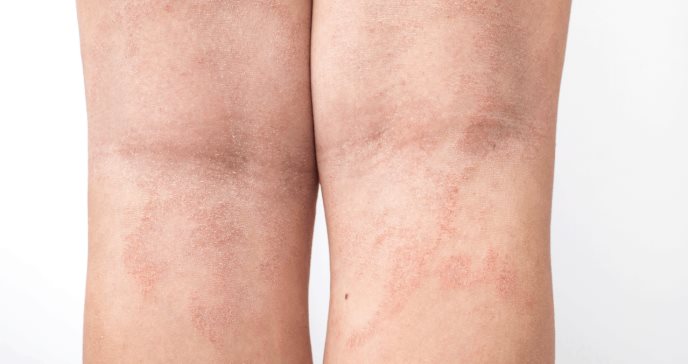
AbbVie anunció hoy que la revista JAMA Dermatology ha publicado los resultados de 24 semanas del estudio de fase 3b Heads Up en el que se evaluó la eficacia y la seguridad de RINVOQ® (upadacitinib, 30 mg, una vez al día) versus DUPIXENT® (dupilumab, 300 mg, en semanas alternas) – ambos en tratamiento de monoterapia, en adultos con dermatitis atópica de moderada a severa que fueron candidatos para recibir terapia sistémica.
La publicación amplía los resultados de primera línea anunciados previamente y demostró que upadacitinib (30 mg, una vez al día) alcanzó superioridad en comparación con dupilumab en el criterio de valoración principal, la proporción de pacientes con al menos un 75 por ciento de mejora en el Índice de Severidad de Eczema (Eczema Severity Index [EASI 75]) en la semana 161.
De los pacientes tratados con upadacitinib, el 71 por ciento alcanzó un EASI 75 en la semana 16 en comparación con el 61 por ciento de los tratados con dupilumab.
Además, upadacitinib demostró una eficacia significativamente mayor desde el punto de vista estadístico entre todos los criterios de valoración secundarios en orden jerárquico en comparación con dupilumab hasta la semana 16, incluida la reducción temprana del picor y tasas de mejoras del aclaramiento de la piel.
“En este estudio, se demostró un inicio de acción más rápido con 30 mg de upadacitinib en comparación con dupilumab, cuando los pacientes experimentaron una reducción del picor en una semana y mejoras en el aclaramiento de la piel a las dos semanas. Además, más pacientes tratados con upadacitinib alcanzaron niveles altos de aclaramiento de la piel, como EASI 90 y 100, a las 16 semanas de tratamiento”, explicó Andrew Blauvelt, MD, MBA, investigador principal del estudio Heads Up y presidente de Oregon Medical Research Center en Portland, Oregón.
“Los resultados de este importante estudio comparativo ayudarán a informar cómo los médicos trabajan con sus pacientes para establecer los objetivos de tratamiento para la dermatitis atópica”, explicó.
Los resultados de los criterios de valoración secundarios en orden jerárquico incluyen:
*Después de una semana de tratamiento, el grupo de upadacitinib de 30 mg demostró una reducción del picor del 31 por ciento (según medido por la Escala de Puntaje Numérico [EPN] del Peor Prurito) en comparación con el 9 por ciento en el grupo de dupilumab (p<0.001).
*Después de dos semanas de tratamiento, el 44 por ciento de las personas que recibieron upadacitinib alcanzó EASI 75 versus el 18 por ciento que recibió dupilumab (p<0.001).
*A las 16 semanas, el 28 por ciento de las personas tratadas con upadacitinib alcanzó un aclaramiento total de la piel (EASI 100; p<0.001) y el 61 por ciento alcanzó un aclaramiento casi total de la piel (EASI 90; p<0.001) en comparación con el 8 por ciento y el 39 por ciento, respectivamente, de las tratadas con dupilumab.
El perfil de seguridad de upadacitinib fue concurrente con lo observado en los estudios fundamentales (pivotal) fase 3, Measure Up 1, Measure Up 2 y AD Up1-3. Hasta la semana 16, los eventos adversos más comunes fueron acné en el grupo de upadacitinib y conjuntivitis en el grupo de dupilumab1. Ocurrieron eventos adversos graves en el 2.9 por ciento de las personas que recibieron upadacitinib y en el 1.2 por ciento de las que recibieron dupilumab1.
Se reportaron infecciones graves con poca frecuencia en ambos grupos de tratamiento (1.1 por ciento en las personas que recibieron upadacitinib y 0.6 por ciento en las que recibieron dupilumab).
No se notificaron malignidades en el grupo de upadacitinib; se notificó un cáncer de piel no melanoma en el grupo de dupilumab. No se notificaron eventos cardiacos principales ni eventos tromboembólicos venosos en ninguno de los dos grupos de tratamiento.
¿Cuál es la información más importante que debo conocer acerca de RINVOQ?
RINVOQ es un medicamento que puede disminuir la capacidad del sistema inmunitario para combatir infecciones. No debe comenzar a tomar RINVOQ si tiene algún tipo de infección a menos que su profesional del cuidado de la salud (PCS) le diga que puede hacerlo.
Vea la Información de prescripción completa, incluida la Guía del medicamento, para RINVOQ.
Esta es la información más importante que debe conocer acerca de RINVOQ. Para más información, hable con su PCS. Se le exhorta a notificar los efectos secundarios negativos de los medicamentos recetados a la FDA. Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088.
Si tiene dificultad para costear su medicamento, AbbVie puede ayudar. Visite AbbVie.com/myAbbVieAssist para conocer más.